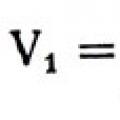Молекулите се предлагат в различни размери и форми. За по -голяма яснота ще изобразим молекула под формата на топка, като си представим, че тя е заобиколена от сферична повърхност, вътре в която са електронните обвивки на нейните атоми (фиг. 4, а). Според съвременните концепции молекулите нямат геометрично определен диаметър. Следователно, за диаметъра d на молекулата, ние се съгласихме да вземем разстоянието между центровете на две молекули (фиг. 4, б), които са се доближили толкова близо, че силите на привличане между тях се балансират от силите на отблъскване.
От курса на химията „е известно, че килограм-молекула (киломол) на всяко вещество, независимо от агрегатното му състояние, съдържа същия брой молекули, наречени число на Авогадро, а именно N A = 6,02 * 10 26 молекули.
Сега нека преценим диаметъра на молекула, например вода. За да направите това, разделяме обема на киломол вода на числото на Авогадро. Киломол вода има маса 18 кг.Ако приемем, че водните молекули са разположени плътно една до друга и нейната плътност 1000 кг / м 3,можем да кажем това 1 kmolобема на водата V = 0,018 m 3... Една молекула вода има обем


Като вземем молекулата за топка и използвайки формулата за обема на топка, ние изчисляваме приблизителния диаметър, в противен случай линейния размер на водната молекула:

Диаметър на молекулата на медта 2,25 * 10 -10 м.Диаметрите на молекулите на газа са от същия ред. Например диаметърът на молекула водород 2,47 * 10 -10 м,въглероден двуокис - 3,32 * 10 -10 m.Това означава, че молекулата има диаметър от порядъка на 10 -10 м.Накрая 1 смНаблизо могат да бъдат разположени 100 милиона молекули.
Нека оценим масата на молекула, например захар (C 12 H 22 O 11). Това изисква маса от киломоли захар (μ = 342,31 kg / kmol)разделено на броя на Авогадро, тоест на броя на молекулите в
Когато два или повече атома химически се свързват помежду си, се създават молекули. Няма значение дали тези атоми са еднакви или са напълно различни един от друг както по форма, така и по размер. Ще разберем какъв е размерът на молекулите и от какво зависи.
Какво представляват молекулите?
В продължение на хилядолетия учените размишляват над мистерията на живота, за това какво точно се случва в началото му. Според най -древните култури животът и всичко -всичко на този свят се състои от основните елементи на природата - земя, въздух, вятър, вода и огън. С течение на времето обаче много философи започнаха да излагат идеята, че всички неща се състоят от малки, неделими неща, които не могат да бъдат създадени и унищожени.
Едва след появата на атомната теория и съвременната химия учените започнаха да постулират, че частиците, взети заедно, са дали началото на основните градивни елементи на всички неща. Така се появява терминът, който в контекста на съвременната теория на частиците се отнася до най -малките единици маса.
Според класическото си определение молекулата е най -малката частица от вещество, която помага да се поддържат нейните химични и физични свойства. Състои се от два или повече атома, както и групи от еднакви или различни атоми, държани заедно от химични сили.
Колко големи са молекулите? В 5 клас естествената история (учебен предмет) дава само обща представа за размера и формата, по -подробно този въпрос се изучава в гимназията в уроците по химия.

Примери за молекули
Молекулите могат да бъдат прости или сложни. Ето няколко примера:
- Н20 (вода);
- N2 (азот);
- O 3 (озон);
- CaO (калциев оксид);
- C6H12O6 (глюкоза).
Молекулите, съставени от два или повече елемента, се наричат съединения. И така, водата, калциевият оксид и глюкозата са съставки. Не всички съединения са молекули, но всички молекули са съединения. Колко големи могат да бъдат те? Какъв е размерът на молекулата? Всеизвестен факт е, че почти всичко около нас се състои от атоми (с изключение на светлината и звука). Общото им тегло ще бъде масата на молекулата.

Молекулна маса
Говорейки за размера на молекулите, повечето учени изхождат от молекулното тегло. Това е общото тегло на всички атоми, включени в него:
- Водата, състояща се от два водородни атома (всеки с една атомна единица маса) и един кислороден атом (16 атомни единици маса), има молекулно тегло 18 (по -точно 18.01528).
- Молекулното тегло на глюкозата е 180.
- ДНК, която е много дълга, може да има молекулно тегло около 1010 (приблизителното тегло на една човешка хромозома).

Измерване в нанометри
В допълнение към масата, можем да измерим и колко големи са молекулите в нанометри. Единицата за вода е с диаметър около 0,27 Nm. ДНК достига 2 nm в диаметър и може да се простира до няколко метра дължина. Трудно е да си представим как такива размери могат да се поберат в една клетка. Съотношението дължина-дебелина на ДНК е невероятно. Тя е 1/100 000 000, като човешка коса, дълга като футболно игрище.

Форми и размери
Колко големи са молекулите? Те се предлагат във всякакви форми и размери. Водата и въглеродният диоксид са едни от най -малките, докато протеините са едни от най -големите. Молекулите са елементи, съставени от атоми, които са свързани помежду си. Разбирането на външния вид на молекулите традиционно е част от химията. Освен неразбираемо странното им химическо поведение, една от важните характеристики на молекулите е техният размер.
Къде знанията за размера на молекулите могат да бъдат особено полезни? Отговорът на този и много други въпроси помага в областта на нанотехнологиите, тъй като концепцията за нанороботите и интелигентните материали задължително се занимава с ефектите на молекулните размери и форми.

Колко големи са молекулите?
В 5 клас естествената история по тази тема дава само обща информация, че всички молекули са съставени от атоми, които са в постоянно разстройство. В гимназията вече можете да видите структурни формули в учебниците по химия, които наподобяват действителната форма на молекулите. Невъзможно е обаче да се измери дължината им с обикновена линийка и за да направите това, трябва да знаете, че молекулите са триизмерни обекти. Изображението им на хартия е проекция върху двуизмерна равнина. Дължината на молекулата се променя от дължините на връзките на нейните ъгли. Има три основни:
- Ъгълът на тетраедра е 109 °, когато всички връзки на този атом с всички останали атоми са единични (само една черта).
- Ъгълът на шестоъгълника е 120 °, когато един атом има една двойна връзка с друг атом.
- Линейният ъгъл е 180 °, когато един атом има или две двойни връзки, или една тройна връзка с друг атом.
Реалните ъгли често се различават от тези ъгли, тъй като трябва да се вземат предвид различни ефекти, включително електростатични взаимодействия.

Как да си представим размера на молекулите: Примери
Колко големи са молекулите? В 5 клас отговорите на този въпрос, както вече казахме, са от общ характер. Учениците знаят, че размерът на посочените стави е много малък. Например, ако превърнете молекула пясък в едно единично пясъчно зърно в цяло пясъчно зърно, тогава под получената маса бихте могли да скриете къща на пет етажа. Колко големи са молекулите? Краткият отговор, който също е по -научен, е следният.
Молекулната маса се приравнява към отношението на масата на цялото вещество към броя на молекулите в веществото или съотношението на моларната маса към константата на Авогадро. Единицата за измерване е килограм. Средното молекулно тегло е 10 -23 -10 -26 kg. Вземете например вода. Молекулното му тегло ще бъде 3 x 10 -26 kg.

Как размерът на молекулата влияе върху силите на привличане?
Отговорност за привличането между молекулите е електромагнитната сила, която се проявява чрез привличане на противоположни и отблъскване на подобни заряди. Електростатичната сила, която съществува между противоположните заряди, доминира при взаимодействията между атомите и между молекулите. В този случай гравитационната сила е толкова малка, че може да се пренебрегне.
В този случай размерът на молекулата влияе върху силата на привличане чрез електронния облак на случайни изкривявания, произтичащи от разпределението на електроните на молекулата. В случай на неполярни частици, проявяващи само слаби ван дер Ваалсови взаимодействия или дисперсионни сили, размерът на молекулите има пряк ефект върху размера на електронния облак, заобикалящ посочената молекула. Колкото по -голямо е то, толкова по -голямо и заредено поле го заобикаля.
По -големият електронен облак означава, че могат да възникнат повече електронни взаимодействия между съседните молекули. В резултат на това една част от молекулата развива временен положителен частичен заряд, докато другата развива отрицателен. Когато това се случи, молекулата може да поляризира електронния облак от съседния. Привличането възниква, защото частична положителна страна на една молекула е привлечена от частична отрицателна страна на друга.

Заключение
И така, какъв е размерът на молекулите? В естествените науки, както разбрахме, можете да намерите само образна представа за масата и размера на тези най -малки частици. Но ние знаем, че има прости и сложни връзки. А вторият включва такова нещо като макромолекула. Това е много голяма единица, като например протеин, който обикновено се прави чрез полимеризация на по -малки субединици (мономери). Обикновено те се състоят от хиляди или повече атоми.
Общинска образователна институция
"Основно средно училище номер 10"
Определяне на диаметъра на молекулите
Лабораторна работа
Изпълнител: Масаев Евгений
7 клас "А"
Ръководител: А. В. Резник
Гуриевски окръг
Въведение
Тази учебна година започнах да уча физика. Научих, че телата, които ни заобикалят, са съставени от малки частици - молекули. Интересувах се от размера на молекулите. Поради много малкия си размер молекулите не могат да се видят с просто око или с обикновен микроскоп. Четох, че молекулите могат да се видят само с електронен микроскоп. Учените са доказали, че молекулите на различни вещества са различни една от друга, а молекулите на едно и също вещество са еднакви. Исках на практика да измеря диаметъра на молекулата. Но за съжаление училищната програма не предвижда изучаване на проблеми от този вид и се оказа трудна задача да се разгледа самостоятелно и трябваше да проуча литературата за методите за определяне на диаметъра на молекулите.
ГлаваАз... Молекули
1.1 От теорията на въпроса
Молекулата в съвременния смисъл е най -малката частица от вещество, която има всичките си химични свойства. Молекулата е способна на независимо съществуване. Той може да се състои от двата идентични атома, например кислород O 2, озон O 3, азот N 2, фосфор P 4, сяра S 6 и т.н., или от различни атоми: това включва молекулите на всички сложни вещества. Най -простите молекули се състоят от един атом: това са молекули на инертни газове - хелий, неон, аргон, криптон, ксенон, радон. В така наречените съединения и полимери с високо молекулно тегло, всяка молекула може да се състои от стотици хиляди атоми.
Експерименталното доказателство за съществуването на молекули е първото най -убедително дадено от френския физик Ж. Перин през 1906 г. при изследването на броуновото движение. Както показа Перин, това е резултат от топлинното движение на молекулите - и нищо друго.
Същността на молекулата може да бъде описана от друга гледна точка: молекулата е стабилна система, състояща се от атомни ядра (еднакви или различни) и околните електрони, а химичните свойства на молекулата се определят от електроните на външните обвивки в атомите. Атомите се комбинират в молекули в повечето случаи чрез химични връзки. Обикновено такава връзка се създава от един, два или три чифта електрони, които са съвместно притежавани от два атома.
Атомите в молекулите са свързани помежду си в определена последователност и се разпределят по определен начин в пространството. Връзките между атомите имат различна сила; се оценява по количеството енергия, което трябва да се изразходва за разкъсване на междуатомните връзки.
Молекулите се характеризират със специфичен размер и форма. По различни методи беше определено, че в 1 cm 3 от всеки газ при нормални условия има около 2,7x10 19 молекули.
За да се разбере колко голямо е това число, човек може да си представи, че молекулата е „тухла“. Тогава, ако вземем броя тухли, равен на броя на молекулите в 1 см 3 газ при нормални условия, и ги поставим плътно върху земната повърхност на цялото земно кълбо, те ще покрият повърхността със слой с височина 120 м, което е почти 4 пъти височината на 10-етажна сграда. Огромният брой молекули на единица обем показва много малкия размер на самите молекули. Например, масата на водна молекула е m = 29,9 x 10 -27 kg. Съответно размерът на молекулите също е малък. Диаметърът на молекулата се счита за минималното разстояние, на което отблъскващите сили им позволяват да се приближат. Концепцията за размера на молекулата обаче е условна, тъй като концепциите на класическата физика не винаги са оправдани на молекулярни разстояния. Средният молекулен размер е около 10-10 m.
Молекулата като система, състояща се от взаимодействащи електрони и ядра, може да бъде в различни състояния и да преминава от едно състояние в друго неволно (под въздействието на външни влияния) или спонтанно. За всички молекули от даден тип е характерен определен набор от състояния, който може да служи за идентифициране на молекули. Като независима формация, молекулата има определен набор от физически свойства във всяко състояние, тези свойства се запазват в една или друга степен по време на прехода от молекули към вещество, състоящо се от тях, и определят свойствата на това вещество. По време на химичните трансформации молекулите на едно вещество обменят атоми с молекулите на друго вещество, разпадат се на молекули с по -малко атоми и също влизат в химични реакции от друг тип. Следователно, химията изучава веществата и техните трансформации в неразривна връзка със структурата и състоянието на молекулите.
Обикновено електрически неутрална частица се нарича молекула. В веществото положителните йони винаги съществуват съвместно с отрицателните.
По броя на атомните ядра, включени в молекулата, се разграничават двуатомни, триатомни и др. Ако броят на атомите в молекулата надвишава стотици и хиляди, молекулата се нарича макромолекула. Сумата от масите на всички атоми, които изграждат молекула, се счита за молекулно тегло. По отношение на молекулното тегло, всички вещества са условно разделени на ниско и високо молекулно тегло.
1.2 Методи за измерване на диаметъра на молекулите
В молекулярната физика основните „действащи лица“ са молекули, невъобразимо малки частици, които съставляват всичко по света. Ясно е, че за да се изследват много явления, е важно да се знаят какви са те, молекулите. По -конкретно какви са техните размери.
Когато се говори за молекули, те обикновено се смятат за малки, еластични, твърди топки. Следователно, да се знае размерът на молекулите означава да се знае техният радиус.
Въпреки малките молекулни размери, физиците са успели да разработят много начини за тяхното определяне. Физика 7 говори за две от тях. Човек използва свойството на някои (много малко) течности да се разпространяват като филм с дебелина една молекула. В друга, размерът на частиците се определя с помощта на сложен инструмент - йонния проектор.
Структурата на молекулите се изучава чрез различни експериментални методи. Електронната дифракция, неутронната дифракция и рентгеновият структурен анализ предоставят пряка информация за структурата на молекулите. Електронната дифракция, метод, който изучава разсейването на електрони от лъч молекули в газовата фаза, дава възможност да се изчислят параметрите на геометричната конфигурация за изолирани сравнително прости молекули. Неутронната дифракция и рентгеновият структурен анализ се ограничават до анализа на структурата на молекули или отделни подредени фрагменти в кондензираната фаза. Рентгеновите изследвания, в допълнение към посочената информация, позволяват да се получат количествени данни за пространственото разпределение на електронната плътност в молекулите.
Спектроскопските методи се основават на индивидуалността на спектрите на химичните съединения, което се дължи на множеството състояния, характерни за всяка молекула и съответните им енергийни нива. Тези методи позволяват качествен и количествен спектрален анализ на веществата.
Спектрите на поглъщане или излъчване в микровълновата област на спектъра позволяват да се изследват преходите между ротационни състояния, да се определят инерционните моменти на молекулите и въз основа на тях - дължините на връзките, ъглите на връзката и други геометрични параметри на молекулите. Инфрачервената спектроскопия по правило изследва преходи между вибрационно-ротационни състояния и се използва широко за спектрално-аналитични цели, тъй като много честоти на вибрации на определени структурни фрагменти на молекули са характерни и се променят слабо при преминаване от една молекула в друга. В същото време инфрачервената спектроскопия дава възможност да се прецени равновесната геометрична конфигурация. Спектрите на молекулите в оптичния и ултравиолетовия честотен диапазон са свързани главно с преходи между електронни състояния. Резултатът от техните изследвания са данни за характеристиките на потенциалните повърхности за различни състояния и стойностите на молекулните константи, които определят тези потенциални повърхности, както и за времето на живот на молекулите в възбудени състояния и вероятността от преходи от едно състояние в друг.
За детайлите на електронната структура на молекулите се предоставя уникална информация чрез фото- и рентгенови електронни спектри, както и оже-спектри, които позволяват да се оцени вида на симетрията на молекулните орбитали и особеностите на електронната плътност разпределение. Лазерната спектроскопия (в различни честотни диапазони), която се характеризира с изключително висока селективност на възбуждане, отвори широки възможности за изследване на отделни състояния на молекули. Импулсната лазерна спектроскопия ви позволява да анализирате структурата на краткотрайните молекули и тяхното превръщане в електромагнитно поле.
Разнообразна информация за структурата и свойствата на молекулите се предоставя чрез изследване на тяхното поведение във външни електрически и магнитни полета.
Съществува обаче един много прост, макар и не най -точен метод за изчисляване на радиусите на молекулите (или атомите). Той се основава на факта, че молекулите на дадено вещество, когато то е в твърдо или течно състояние, могат да се считат за плътно съседни един на друг. В този случай, за груба оценка, можем да приемем, че обемът Vнякаква маса мвеществото е просто равно на сумата от обемите на молекулите, които съдържа. След това получаваме обема на една молекула чрез разделяне на обема Vпо броя на молекулите н.
Броят молекули в тяло с маса меднакво, както знаете,
, където М- моларна маса на вещество нА е числото на Авогадро. Оттук и обемът V 0 от една молекула се определя от равенството.Този израз включва съотношението на обема на веществото към неговата маса. Обратното отношение
Моларна маса на водата:
Ако молекулите в течността са плътно опаковани и всяка от тях се побира в куб с обем V 1с ребро д, тогава .
Обем на една молекула :, където: V mкойто се моли Н Ае номерът на Авогадро.
Обемът на един мол течност :, където: М-нейната моларна маса, - плътност.
Диаметър на молекулата:
Изчислявайки, имаме: 
Относителното молекулно тегло на алуминия Mr = 27. Определете основните му молекулярни характеристики.
1. Моларна маса на алуминия: M = Mr. 10 -3 М = 27. 10 -3
Намерете концентрацията на молекули, хелий (M = 4.10 -3 kg / mol) при нормални условия (p = 10 5 Pa, T = 273K), тяхната средноквадратична скорост и плътност на газа. От каква дълбочина в резервоара излиза въздушен мехур, ако в същото време обемът му се удвои?Не знаем дали температурата на въздуха в балона остава същата. Ако е същото, тогава процесът на изкачване се описва с уравнението pV = const... Ако се промени, тогава уравнението pV / T = const.
Нека преценим дали правим голяма грешка, ако пренебрегнем температурната промяна.
Да предположим, че имаме най -неблагоприятния резултат: Нека времето е много горещо и температурата на водата на повърхността на резервоара да достигне + 25 ° C (298 K). В долната част температурата не може да бъде по -ниска от +4 0 C (277K), тъй като тази температура съответства на максималната плътност на водата. Така температурната разлика е 21K. По отношение на началната температура тази стойност е %%. Малко вероятно е да срещнем такова водно тяло, температурната разлика между повърхността и дъното на което е равна на посочената стойност. Освен това балонът изскача достатъчно бързо и е малко вероятно той да има време да се затопли напълно по време на изкачването. По този начин реалната грешка ще бъде значително по-малка и можем напълно да пренебрегнем промяната в температурата на въздуха в балона и да използваме закона на Бойл-Мариот, за да опишем процеса: p 1 V 1 = p 2 V 2, където: p 1- налягане на въздуха в балона на дълбочина h (p 1 = p atm. + rgh), p 2- налягане на въздуха в балона близо до повърхността. p 2 = p атм.
 |
(p atm + rgh) V = p atm 2V; ;
|
Въздухът е блокиран в чаша, обърната с главата надолу. Проблемът гласи, че стъклото започва да потъва само на определена дълбочина. Очевидно, ако се пусне на дълбочина по -малка от определена критична дълбочина, тя ще изплува нагоре (предполага се, че стъклото е разположено строго вертикално и не се преобръща).
Нивото, над което стъклото плува и под което потъва, се характеризира с равенството на силите, приложени към стъклото от различни страни.
Силите, действащи върху стъклото във вертикална посока, са гравитацията надолу и нагоре.
Силата на плаваемостта е свързана с плътността на течността, в която е поставено стъклото, и обема на течността, изместен от него.
Силата на тежестта, действаща върху стъклото, е правопропорционална на неговата маса.
От контекста на проблема следва, че с потъването на стъклото, възходящата сила намалява. Намаляване на силата на плаваемост може да възникне само поради намаляване на обема на изместената течност, тъй като течностите са практически несвиваеми и плътността на водата на повърхността и на определена дълбочина е еднаква.
Намаляване на обема на изместената течност може да възникне поради компресията на въздуха в стъклото, което от своя страна може да възникне поради увеличаване на налягането. Промяната в температурата, когато стъклото е потопено, може да бъде пренебрегнато, ако не се интересуваме от твърде висока точност на резултата. Обосновката е дадена в предишния пример.
Връзката между налягането на газа и неговия обем при постоянна температура се изразява от закона на Бойл-Мариот.
Налягането на течността се увеличава с дълбочина и се предава във всички посоки, включително нагоре, по същия начин.
Хидростатичното налягане е правопропорционално на плътността на течността и нейната височина (дълбочина на потапяне).
След като записахме като начално уравнение уравнението, характеризиращо състоянието на равновесие на стъклото, последователно замествайки изразите, намерени по време на анализа на проблема и решавайки полученото уравнение по отношение на желаната дълбочина, стигаме до извода, че за да за да получим числов отговор, трябва да знаем стойностите на плътността на водата, атмосферното налягане, масовото стъкло, неговия обем и ускорението на гравитацията.
Всички горни разсъждения могат да бъдат представени по следния начин:
![]()
![]()

Тъй като в текста на проблема няма данни, ние сами ще ги зададем.
Дадено:
Плътността на водата r = 10 3 kg / m 3.
Атмосферно налягане 10 5 Pa.
Обем на стъклото 200 мл = 2 00. 10 -3 l = 2. 10 -4 м 3.
Тегло на чашата 50 g = 5. 10 -2 кг.
Ускорение на свободното падане g = 10 m / s 2.
Числово решение:

|
Проблемът с повдигането на балон, също като проблема с потъващото стъкло, може да се класифицира като статичен проблем.
Топката ще започне да се издига по същия начин, по който стъклото ще потъне, веднага щом бъде нарушено равенството на силите, приложени към тези тела и насочени нагоре и надолу. Топката, също като стъклото, се влияе от гравитацията надолу и плаваща нагоре.
Плаваемостта е свързана с плътността на студения въздух, заобикалящ топката. Тази плътност може да се намери от уравнението на Менделеев-Клапейрон.
Силата на тежестта е правопропорционална на масата на топката. Масата на топката от своя страна се състои от масата на черупката и масата на горещ въздух вътре в нея. Масата на горещия въздух може да се намери и от уравнението на Менделеев-Клапейрон.
Схематично мотивите могат да бъдат показани по следния начин:
![]()

От уравнението можете да изразите желаната стойност, да оцените възможните стойности на количествата, необходими за получаване на числено решение на проблема, да замените тези величини в полученото уравнение и да намерите отговора в числова форма.
Затворен съд съдържа 200 г хелий. Газът преминава през сложен процес. Промяната в неговите параметри се отразява в графиката на зависимостта на обема от абсолютната температура.1. Изразете масата на газа в SI.
2. Какво е относителното молекулно тегло на този газ?
3. Каква е моларната маса на този газ (в SI)?
4. Какво е количеството на веществото, съдържащо се в съда?
5. Колко молекули газ има в съда?
6. Каква е масата на една молекула на даден газ?
7. Назовете процесите в раздели 1-2, 2-3, 3-1.
8. Определете обема на газа в точки 1,2, 3, 4 в ml, l, m 3.
9. Определете температурата на газа в точки 1,2, 3, 4 при 0 С, К.
10. Определете налягането на газа в точки 1, 2, 3, 4 в mm. rt. Изкуство. , банкомат, Па.
11. Начертайте този процес на графика налягане спрямо абсолютната температура.
12. Начертайте този процес върху графика налягане спрямо обем.
Инструкции за решение:
1. Вижте условие.
2. Относителното молекулно тегло на елемент се определя с помощта на периодичната таблица.
3. M = M r· 10 -3 kg / mol.
7. стр= const - изобарично; V= const-isochoric; T= const - изотермично.
8,1 m 3 = 10 3 l; 1 л = 10 3 мл. девет. T = t+ 273.10.1 атм. = 10 5 Pa = 760 mm Hg Изкуство.
8-10. Можете да използвате уравнението на Менделеев-Клапейрон или газовите закони на Бойл-Мариот, Гей-Люсак, Чарлз.
Отговори на проблема
| m = 0,2 кг | |||||||
| M r = 4 | |||||||
| M = 4 · 10 -3 kg / mol | |||||||
| n = 50 mol | |||||||
| N = 3 10 25 | |||||||
| m = 6,7 10 -27 кг | |||||||
| 1 - 2 - изобарен | |||||||
| 2 - 3 - изохорен | |||||||
| 3 - 1 - изотермичен | |||||||
| № | мл | л | m 3 | ||||
| 2 · 10 5 | 0,2 | ||||||
| 7 · 10 5 | 0,7 | ||||||
| 7 · 10 5 | 0,7 | ||||||
| 4 · 10 5 | 0,4 | ||||||
| № | 0 С | ДА СЕ | |||||
| № | mmHg. | банкомат | Па | ||||
| 7,6 · 10 3 | 10 6 | ||||||
| 7,6 · 10 3 | 10 6 | ||||||
| 2,28 · 10 3 | 0,3 10 6 | ||||||
| 3,8 · 10 3 | 0,5 · 10 6 | ||||||
 |
 |
||||||
MKT е лесно!
"Нищо не съществува освен атомите и празното пространство ..." - Демокрит
"Всяко тяло може да се дели неограничено" - Аристотел
Основни принципи на молекулярно -кинетичната теория (MKT)
Предназначение на ICB- това е обяснение за структурата и свойствата на различните макроскопични тела и топлинните явления, които се случват в тях, движението и взаимодействието на частиците, които изграждат телата.
Макроскопични тела- това са големи тела, състоящи се от огромен брой молекули.
Топлинни явления- явления, свързани с нагряване и охлаждане на тела.
Основни изявления на ICB
1. Веществото се състои от частици (молекули и атоми).
2. Между частиците има празнини.
3. Частиците се движат произволно и непрекъснато.
4. Частиците взаимодействат помежду си (привличат и отблъскват).
Потвърждение на ICB:
1. експериментален
- механично раздробяване на веществото; разтваряне на вещество във вода; компресиране и разширяване на газове; изпаряване; деформация на тела; дифузия; Експериментът на Бригман: маслото се излива в съд, буталото се притиска отгоре на маслото, при налягане от 10 000 атм, маслото започва да прониква през стените на стоманен съд;
Дифузия; Брауново движение на частици в течност под въздействието на молекули;
Лоша свиваемост на твърди вещества и течности; значителни усилия за разкъсване на твърди частици; сливане на капчици течност;
2. директно
- фотография, определяне на размера на частиците.
Брауново движение
Брауновото движение е топлинното движение на суспендирани частици в течност (или газ).
Брауновото движение стана доказателство за непрекъснатото и хаотично (топлинно) движение на молекулите на материята.
- открит от английския ботаник Р. Браун през 1827 г.
- теоретично обяснение, основано на MKT, е дадено от А. Айнщайн през 1905 г.
- експериментално потвърдено от френския физик Ж. Перин.
Молекулна маса и размер
Размер на частиците
Диаметърът на всеки атом е около cm.

Броят на молекулите в дадено вещество
където V е обемът на веществото, Vo е обемът на една молекула
Маса на една молекула
където m е масата на веществото,
N е броят на молекулите в веществото
Единица за маса в SI: [m] = 1 kg
В атомната физика масата обикновено се измерва в единици атомна маса (amu).
Обикновено се счита за 1 аму. :
Относително молекулно тегло на материята
За удобство на изчисленията се въвежда стойност - относителното молекулно тегло на веществото.
Масата на молекула на всяко вещество може да се сравни с 1/12 от масата на въглеродна молекула.

където числителят е масата на молекулата, а знаменателят е 1/12 от масата на въглеродния атом
Това количество е безразмерно, т.е. няма мерни единици
Относителна атомна маса на химичен елемент

където числителят е масата на атома, а знаменателят е 1/12 от масата на въглеродния атом
Количеството е безразмерно, т.е. няма мерни единици
Относителната атомна маса на всеки химичен елемент е дадена в периодичната таблица.
Друг начин за определяне на относителното молекулно тегло на веществото
Относителното молекулно тегло на веществото е равно на сумата от относителните атомни маси на химичните елементи, съставляващи молекулата на веществото.
Взимаме относителната атомна маса на всеки химичен елемент от периодичната таблица!)
Количество вещество
Количеството на веществото (ν) определя относителния брой молекули в тялото.
където N е броят на молекулите в тялото, а Na е константата на Авогадро
Единицата SI за количеството вещество: [ν] = 1 mol
1 мол- Това е количеството вещество, което съдържа толкова молекули (или атоми), колкото атомите се съдържат във въглерод с тегло 0,012 кг.
Помня!
1 мол от всяко вещество съдържа същия брой атоми или молекули!
Но!
Едно и също количество вещество за различни вещества има различна маса!
Константата на Авогадро
Броят на атомите в 1 мол от всяко вещество се нарича число на Авогадро или константа на Авогадро:
Моларна маса
Моларната маса (М) е масата на вещество, взето в един мол, или по друг начин, това е масата на един мол от вещество.
Молекулна маса
- Константата на Авогадро
Моларна единица маса: [M] = 1 kg / mol.
Формули за решаване на проблеми
Тези формули се получават чрез заместване на горните формули.
Масата на произволно количество вещество