Като се разбира с енергията на електроните, ние ще се опитаме да разберем как се движат електроните в атома, като имат различни енергийни ценности и като цяло, са в различни държави (при различни орбити).

Поради особеностите на поведението на електрона, с които се срещнахме в първия параграф, ние, жителите на макромир, е невъзможно да си представим естеството на такова движение. Това се дължи на факта, че в макромир, в съответствие с представянето на съвременната физика, просто няма аналогия за него. Въпреки това, позицията не е безнадеждна - можем да използваме модела на електронното поведение в атома, в който идеята за електронен облак (ЕО).


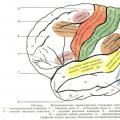
За да разберем какво е то, ние приемаме, че можем да имаме много пъти "да направим снимка" електрон в атом (например в водороден атом), т.е. точно да фиксира позицията си във всеки момент от времето. Принципът на несигурността не забранява това. Като се налагат един на друг тези "снимки", ние получаваме картината, показана на фигура 6.6 но. Ако поправяме само позицията на електрона на равнината, в която лежи ядрото, изображението ще бъде малко по-различно (виж фиг. 6.6 б.). И двете чертежи ни дават представа за електронния облак: рисуване но - Изглед на този облак отстрани и рисуване б. - Раздел от облака със самолет, минаващ през ядрото. Снимка но отразява появата на облаците и рисуване б. дава представа за неговата вътрешна структура.
На различни места на електронния облак е вероятно да открие електрон може да бъде различен.
Различната плътност на точки в различни части на фигура 6.6 съответства на различната вероятност за намиране на електрон в тези части на електронния облак.
Вероятността за откриване на електрон във всяка част на облака се характеризира с физическа стойност, наречена електронна плътност (R E). Той се дефинира като съотношение на броя на електроните ( Н. д) до обем ( В.), които те равномерно попълват:
 .
.
Колкото по-голяма е електронната плътност, толкова по-висока е вероятността за намиране на електрон в тази част на облака (и основанията са точки на фиг. 6.6).
Електронната плътност намалява рязко с нарастващо разстояние от ядрото, но е теоретично равно на нула само на безкрайно разстояние от него. От това следва, че Yi няма ясни граници. По посока на ядрото електронната плътност намалява още по-рязко и близо до нея е почти равна на нула.
Електронният облак се характеризира с размера, формата и разпределението в нея на електронната плътност.
Всичко, което говорихме за електронния облак, принадлежи на EO на един орбитал, но електронът може да бъде разположен на различен орбитал. Естествено, електронните облаци в тези случаи също ще бъдат различни, т.е. те ще се различават по размер, форма и разпределение на електронната плътност.
Както отбелязахме, електронният облак няма ясни граници, като краищата изглеждат замъглени в пространството. Какво да разберем под размера на такъв обект и как да го опиша?
За да отговорите на тези въпроси, ще трябва да разберем по-подробно как "подредени" някои електронни облаци, т.е. каква е тяхната структура. Структурата на такава необичайна обект, като електронен облак, се характеризира само с разпределението чрез обема на електронната плътност. Първо се запознайте със структурата на най-простите електронни облаци.

Да започнем с 1. с.- Не. На върха на ориза. 6.7 показва напречното сечение на този облак с равнина, минаваща през ядрото на атома. В долната част на фигурата се поставя графика, показваща как се променя плътността на електронността в този облак. Такъв график може да изгради много малък "наблюдател", който лети през ос х. и непрекъснато измерване на електронната плътност. Точно същият график ще изгради нашия "наблюдател", ако Flew след 1 с.- В някаква друга посока, но непременно през центъра на облака. Следователно, в 1 с.- разпределението на електронната плътност не зависи от посоката, а формата на този облак е сферичен.
Но не винаги е лесно да си представим формата на електронен облак, рисувайки само графиките на разпределението на електронната плътност. Следователно, обикновено формата на електронен облак го характеризира гранична повърхност.
Като гранична повърхност, такава повърхност е избрана, вътре, която общата вероятност открива електрон, е достатъчно голяма (например: 90; 95 или дори 99%). Но комплектите такива повърхности могат да бъдат избрани за всеки облак, затова сред тях изберете една - повърхността, при която във всеки един момент вероятността за електрона е същата. Има и друг начин за избор на гранична повърхност. В този случай, сред повърхностите със същото (на всяка точка) електронна плътност, повърхността е избрана, върху която електронната плътност е изключително незначително (например, 0.01 или 0.001 e /\u003e a 3, т.е. 1.6 ° 10 ° или 1.6? 10 8 cl / m 3). Граничните повърхности, избрани от тези два метода, се различават по външен вид, се различават един от друг.

Изграждаме гранична повърхност 1 с.- Не. На фиг. 6.7 Спомагателни линии, свързани с тази конструкция, са изобразени от пунктирани. В резултат на това ще получим две сфери: външни ( но) и вътрешен ( б.), между които вероятността за откриване на електрон е равна на 90%. Вътрешната сфера е малка, разположена близо до ядрото и когато се образува атом на химични връзки, присъствието му не се появява, така че обикновено се казва, че 1 с.- Ео има форма на топка.
2. пс.-Eo (фиг. 6.8). Състои се от две идентични части, симетрични за центъра на облака. Между тях, в самолета м. (перпендикулярно на чертежа), електронът не може да бъде. Гранична повърхност 2. пс.- Неговото напречно сечение е посочено в чертежа на писмото но) Прилича на две половини на оранжево и е тяло на въртене (Най-простите тела на въртене са цилиндърът, конуса, топка и торус (приблизителният тор е имал бейгъл) с ос х.. Ако нашият "наблюдател" лети през този облак по оста х.след това диаграмата, която ще изгради, няма да бъде много различна от същия график за 1 с.-Ео, само височината на максималната вода ще бъде малко по-малка. Във всяка друга посока (с изключение на тези, които лежат в самолета м.), например, по директно е.Електронната плътност ще бъде още по-малка, но максималната крива ще остане на същите разстояния от ядрото (виж долния график). Това постоянство на Максима е характерно за други електронни облаци, което ни позволява да избираме във всеки облак в сферата " от "с радиус, в края на коя електронна плътност в тази посока е максимална.
Такъв постоянен радиус и характеризира размера на електронния облак. Този радиус се нарича радиус на електронния облаки означават r. Eo. В случая на орбиталите, разглеждани от нас, на това разстояние от ядрото, електронът ще бъде завъртян, ако не е притежавал свойствата на вълната.

2пс.-Полюгирани с три орбитала, следователно в атома може да бъде три 2 р-Eo. И тъй като електроните са взаимно отблъснати, тези облаци са разположени в пространството, така че максималите на тяхната електронна плътност са възможно най-далеч един от друг. Това е възможно само ако оста на облаците ще бъде взаимно перпендикулярно, например, насочено по осите на правоъгълната координатна система. Следователно 2. р-Eo и означаваме: 2 r. X -, 2 r. Y - и 2 пс. Z -eo (фиг. 6.9). Ако всеки от тези облаци е оформен от един или два електрона, тогава общият електронен облак от всички електрони sublayer поради добавянето на електронна плътност ще има сферична форма (като 1S-eo). Същата сферична форма ще има общите електронни облаци от всеки сублайер, освен ако, разбира се, всеки от отделните облаци ще бъде оформен от един или два електрона.
Формата и структурата на други електронни облаци е по-сложна. Така 2. с.-Eo, като всичко с.- булката със сферичен, двуслоен (фиг. 6.10 но). Вътре във външния слой с основната максимална електронна плътност има друг слой със значително по-малка електронна плътност.
3пс.-Ео се състои от четири части (фиг. 6.10 б.). Две големи площи са сходни по форма на половинки 2 р-EO, но две малки площи с по-малко електронна плътност се намират по-близо до ядрото. В космическата ос 3 пс.-Електронни облаци, както и ос 2 р-Eo, взаимно перпендикулярно.
С увеличаване на основния квантов номер н. Формата на електронни облаци (c е същото л.) Всичко е все по-сложно, но външните региони на такива облаци остават сходни, геометрично сходни.
Дори по-силен се усложнява от формата на облаци с увеличаване на орбиталния квантов число. Разгледа форма 3. д.- Полша. От петте облака от този сублайер четири във форма са напълно еднакви, а петата от тях се различава (фиг. 6.11) (всъщност ситуацията с петия облак е малко по-сложна) всяка от четирите идентични 3 д.- Съдържанието се формира от четири области, наподобяващи заоблени оранжеви филийки. Петият облак се състои от три части, две от които дистанционно приличат на 2 r.- дърво, и трети форми, подобни на причините около първите две.
Размерите на електронните облаци зависят от обвинението на ядрото: колкото по-силно е зарядът на ядрото, толкова по-силен е електронът и по-малкият размер на електронния облак. Със същия заряд на ядрото, размерът на облака зависи преди всичко от главния квантов брой н.. Визуално тази зависимост е представена на фиг. 6.12 във формата графики за размер на електронните облаци. На тази диаграма, вертикалната ос се отлага (без стриктно спазване на мащаба на радиусите на електронните облаци, а хоризонталната ос е орбитален квантов номер. Позициите на EO Radii на диаграмата са символично маркирани с кръгове.

Радиусите на електронните облаци със същите стойности на основното квантово число са приблизително равни и с различни стойности н - се различават значително. Поради това електронната обвивка на атома се оказва наслоен. (Точни квантови механични изчисления показват, че радиусите на облаците от един слой се различават леко, но тези разлики са незначителни)
Електронният слой се формира от облаците орбитали на едно електронно ниво. Така че първият електронен слой е оформен с един 1 с.-Eo, вторият - един 2 с.-Eo и три 2 r.- Ео, третата - една - една 3 с.-Ho, три 3 r.-Eo и пет 3 д.- Не. Общият брой на електронните облаци във всеки електронен слой е равен н. 2, където н. - основното квантово число, което служи едновременно и номера на електронния слой.
Облаците от същия слой, характеризиращ се само с стойностите на магнитен квантово число, съответстват на орбиталите на един сън. Кога r.-Приране на различни стойности м. Съответства само различна ориентация на електронните облаци. В облаците на една ЕПА с голяма стойност l, например, в 3 д.- Полша, също различна форма.
Електронен облак, гранична повърхност EO, EO форма, радиус на EO, диаграма на езерото, електронен слой.
1. са електронни облаци в природата? И електрони?
2. Опитайте се да намерите аналогои между електронната обвивка и многоетажна жилищна сграда на оригиналната архитектура.
3. След като позицията на граничната повърхност на електронния облак се избира произволно (по-точно - конвенционално)?
4. Точкови промени в плътността на електроните, записани от "наблюдателя", летящ през 1 с.-Eo по директно A и B (фиг. 6.13).
5. представител на електронната плътност, записана от "наблюдателя", летящ през 2 r.- а) през центъра на атома в посоката, перпендикулярна на оста х. (Фиг.6.8); б) успоредно на оста х.извън сферата на най-високата електронна плътност; в) успоредно на оста х., улавяне на сферата на най-високата електронна плътност.
6. Какви електронни облаци образуват втория електронен слой?
7. Електронните облаци на орбиталите се различават един от друг със следните комплекти квантови числа: а) н. = 2, л. = 0, м. \u003d 0 I. н. = 2, л. = 1, м. \u003d 0; б) н. = 2, л. = 1, м. \u003d 0 I. н. = 2, л. = 1, м. \u003d 1; в) н. = 1, л. = 0, м.\u003d 0 I. н. = 2, л. = 0, м. = 0?
8. Колко електронни облаци образуват напълно напълнен четвърти електронен слой?
9. какъв електронен облак от същия атом е по-голям в размер А) 2 r.-Eo или 3. r.-Ео, б) 2 r.-Eo или 3. с.-Eo, в) 1 с.-Eo или 2. r.-
10.Kone от електронни облаци Вижте повече: 1 с.- атом на водород, или 1 с.- атом хелий?
11. Как мислите колко пъти радиусът на 1S-eo уран атом е по-малък от радиуса на същия облак на водородния атом?
12. Какво от следните електронни облаци от същия атом са приблизително същите измерения: 1S-EO, 4P-EOB 3D-EO, 4S-YI, 3S-EO?
В Текущите учебници за химия за общи образователни институции и в химически ползи за допускане до университети в описанието на състоянието на електроните в АТО използва представянето на квантовата механика, според която микрочастиците имат вълна, а вълните имат свойствата на свойствата частици. Ето защо те използват концепциите за квантова механика: "Орбитал" и "Електронният облак". Обикновено в учебници и при преподаване на СПИН се идентифицират тези различни понятия.
Например, в учебник за общи институции за обща образование, чийто ръкопис е награден на конкуренцията на училищните учебници в химията през 1987 г., идентифицирането на концепциите се извършва, както следва: "Електронът при движение, например, в Водородният атом образува облак от форма на топка, чиято плътност е най-голямата на разстояние 0.53 10-10 м от ядрото ... електрони, които при движещи се облачни облаци, тя е обичайна, наречена с.-Електрони. Електронните облаци също се наричат \u200b\u200bорбитални. "
Освен това се твърди, че "на същия орбитал може да има само два електрона с противоположни (анти-паралелни) завъртания" [виж 1, стр. 116]. Това твърдение не съответства на вече обяснено обяснение, според което електроните образуват електронни облаци, които също се наричат \u200b\u200bорбитали, а не върху тях.
При описването на структурата на електронните обвивки на борените атоми, въглерод и азот е показан, че орбиталът може не само да бъде оформен от електрони, но и да го напълни: "Така на всяко енергийно ниво, започвайки от второто, може да се появи от второто, което може да бъде Бъдете трима r.-. В борния атом в, въглерод С и азот N 2 пс.- избягване на един електрон "[виж 1, стр. 118]. Възниква въпросът: как могат да се пълнят електроните на орбитал, който се формира от електрон, който се движи около ядрото? Няма отговор на този въпрос в учебника.
В шестото издание на друг учебник по химия, такова обяснение е дадено: "Точно като бързоживерна игла за шевни машини, пронизваща тъканта, бродиращия модел върху него и неизменно по-бърз електрон" бродери "само не е плосък, и обемният модел на електронния облак - орбитал. Това обяснение се превръща в определение на концепцията: "Пространството около ядрото, където най-вероятно ще открият този електрон, се нарича орбитал от този електрон или облак на електрони."
На тази "база" близо до зоната на окончанието, наречена орбитална или електронен облак, се дължи на енергията, размера и формата: "В зависимост от енергията, електронните облаци се различават по размер ... орбитал може да има различна форма . Така че, всяко ново енергийно ниво в атома започва с с.-Вюбители, който има сферична форма. "
В химия обезщетение за влизане в университетите, което е публикувано повече от двадесет години, електронният облак е описан по следния начин: "Електронът в атома няма траектория на движение. Квантовата механика разглежда вероятността за намиране на електрон в пространството около ядрото. Бързо движещият се електрон може да бъде в която и да е част от пространството около ядрото, а изцедените позиции се считат за електронен облак с определена плътност на отрицателния заряд ... максималната плътност съответства на най-голямата вероятност за намиране на електрон в тази част от атомното пространство. "
Въз основа на това обяснение, понятието "орбитал" се определя, както следва: "Пространството около ядрото, в което електронът най-вероятно ще се нарича орбитал." При описването на структурата на електронните черупки на атомите от близкото минало пространство, наречено орбитал, се приписва на формата, пространствено място (!) И е показан в коя последователност е напълнена с електрони. В същото време, за съжаление, не е обяснено, че тя трябва да бъде разбрана под пространственото подреждане на почти единствено пространство.
При описване на свойствата на ковалентна връзка, почти орбиталът се приписва на хибридизация. Например, с обяснение на една и съща якост на химичните връзки в молекулата на берил хлорид, тя е показана: "Същата сила на свързване се дължи на хибридизация на валент (външни) орбитали, т.е. смесване и подравняване във форма и енергия. В този случай първоначалната форма и енергията на атомните орбитали са взаимозаменяеми и се образуват електронни орбитали със същата форма и енергия "[виж 3, p. 78].
Освен това показва, че "при образуването на химични връзки в молекулата на Becl 2 участва с.- и едно r.-Електрон на централния атом, т.е. Берилий. В този случай се случва sp.-Пийбразизация на орбитала. "
При примера на молекулите на бор и метан хлорид се разглеждат молекулите sp. 2 - I. sp. 3-хибридизация на атомни орбитали на бор и въглеродни атоми.
От Възстановяване, за да се отбележи, че е прието в учебници и учебници за химия Тълкуването на концепцията за "орбитал" няма нищо общо с квантовата механика, защото в нея електронният облак се счита за истински материал, а орбиталът се нарича "функция" на пространствени променливи на един електрон, което има смисъл на вълната функциите на отделен електрон в областта на ефективен атомен или молекулен остров. "
Ето защо е направена идеята за замяна на термина "орбитал" към термина "орбита": "авторът би предпочел да използва термина" орбита "като обичайното име" интегрално "," диференциално ", но най-новото Години в нашата образователна литература, за съжаление, се наслаждавайте на "орбиталния" израз. "
Орбитал описва движението на електронното поле в сърцевината и се характеризира с три квантови номера - н., л. и м.: "Квантово число л., цели и неотрицателни, определя орбиталния момент на електронния импулс или по-скоро площад: л. (л. + 1). Quantum номер м., цели и не повече от абсолютна стойност л.представлява проекцията на орбиталния момент на пулса до произволно избраната ос на квантуване z.. Основното квантово число н. Числа орбитална енергия e С цел увеличаване. "
Въз основа на това се смята, че орбиталът определя вида на електронния облак: "В А. В това стационарно състояние възниква сложен процес, който се характеризира с целия набор от възможни действия на електрон, който е в това състояние , например, целият набор от възможни "локализации" на електрон, когато е освободен от и тези. Съответния "облак". За да определите вида на "облаците" в квантовата теория А. Намерете функция на вълната, която характеризира процеса на осцилация в A. квадратна амплитуда на функциите на вълната, дава вида "облаци".
Идентифицирането на понятията "електронен облак" и "орбитал", извършен в образователната литература в химията, се счита за грешка в литературата за квантовата механика: "В много учебници състоянието на електрона в атома се характеризира с това Квантово число н., л. и м.И да илюстрират графични образи на реални Ao (електронни облаци. - V.Sh.)" [см. 6,
от. 34].
Учениците от общите образователни институции не изучават квантовата механика, не могат да разберат съдържанието на понятията за "орбитал" и "електронен облак", и следователно в учебниците по химия за тези образователни институции и в химически ползи за кандидатите за университетите трябва да бъдат изоставени от използването на концепцията за "орбитал" и използвайте концепцията за "електронен облак".
Пс Формирането на концепцията за "електронен облак" трябва да бъде информиран с учениците, че електронът се върти около ядрото на атом с невъобразима скорост. Така че, за 1 s прави толкова много революции около Atom Core, колко революции правят витлото на въздухоплавателното средство около ос за 5-5,5 години непрекъсната работа на двигателя. След това съобщавате, че витлото на самолета формира "облак", разположен в една и съща равнина, а електронът образува насипен облак, формата и размерът на които зависят от електронната енергия.
Програмата на химията на вторичните образователни институции предвижда изследването на структурата на електронните черупки само от тези атоми, които са посочени в първите четири периода на периодичната система на D.I. Иметелеев. Използвайки периодичната система, ние показваме, че броят на енергийните нива в електронната обвивка на атома е равен на номера на периода, в който се намира химическият елемент. Всяко енергийно ниво се състои от половин година, чийто брой е равен на номера на нивото.
При разглеждане на структурата на електронните обвивки на атомите на първия период на периодичната система, D.I. Remeeleev, ние формираме понятието за с.-Електрони, сдвояване на електрони и с.-Прождащи енергийни нива. В този случай ние съобщаваме, че един електрон, разположен в електронната обвивка на водородния атом, образува електронен облак от сферична форма и се нарича с.-Електрон (фиг.). Тъй като сферичният електронен облак отнема само една позиция в близкото минаващо пространство, след това да се определи с.Електронът в графичната формула е даден един квадрат, който се нарича енергийна клетка.
Сдвояването на електрони показва при разглеждането на структурата на електронната обвивка на хелий атома. В същото време отбелязваме, че и двата електрона се въртят около атомното ядро \u200b\u200bса с.-Електрони. От сферичен електронен облак с.-Електрон може само да заема една позиция в пространството, а след това тези две с.-Електрон образуват един общ електронен облак от сферична форма за тях, чиято плътност е два пъти по-голяма от плътността на електронния облак от един електрон.
Образуването на един обект на електрони с два електрона ние наричаме сдвояването на електрони. В същото време ви информираме, че само електрони с противоположни завъртания могат да бъдат сдвоени. След това напишете електронната и графична електронна формула на хелиевия атом и ние обясняваме, че в графичната електронна формула, сдвоените електрони са означени в една енергийна клетка в две противоположни насочени стрелки.
При разглеждане на структурата на електронните обвивки на атомите на елементите на втория период на периодичната система, D.I. Remeeleev, формираща концепцията за пс.- Електрони и О. пс.-Прождащи енергийни нива. В същото време показваме, че всяко ниво на енергия започва
с.- придвижване, върху което не може да се намират повече от два сдвоени електрона. Останалите електрони на второто енергийно ниво имат по-голяма енергия от 2 с.-Електрони и следователно образуват електронни облаци от форма на гири (cm. Фиг.). Такива електронни облаци са разположени в атома взаимно перпендикулярно и насочени по осите на пространствените координати.
Електрони, образуващи електронни облаци, обзаведени с дъмбел, повикване r.-Електронни и превъзходния, на който са поставени - r.- търговия. Тъй като електронните облаци
r.-Електроните заемат три позиции в пространството, след това в графични електронни формули
r.-Полюгидите се обозначават с три енергийни клетки. Сдвояване r.-Електронните се срещат само след електронните облаци на първите три r.- Електроните ще вземат три позиции за тях в космоса.
При разглеждане на структурата на електронните обвивки на атомите на елементите на третия период на периодичната система, D.I. Remeeleeve показват, че третото енергийно ниво се състои от три надмощия, от които електроните се пълнят само с.- I. пс.- Движещ се. Последователността на пълнене на тези подкози и електрона е същата като в атомите на елементите на втория период на периодичната система.
При разглеждане на структурата на електронните черупки на атомите на елементите на четвъртия период на периодичната система, D.i. Remeeleeve, показват, че четвъртото енергийно ниво се състои от четири надмощия, от които електроните се изпълняват само с.- I. пс.- Движещ се. Останалите електрони (до десет) последователно напълват третия сублайлер на третото енергийно ниво. Тези електрони имат по-голяма енергия от електроните 3 пс.-Продукция и образуване на електронни облаци от сложна конфигурация (виж фиг.), Която може да заема пет позиции в пространството.
Такива електрони се наричат д.-Електронни и зърното, които те заемат - д.- търговия. Сдвояване д.- Електроните се появяват след като техните електронни облаци ще заемат всичките пет позиции в близкото място. В графични електронни формули д.-Полуките се обозначават с пет енергийни клетки.
В заключение, ние съобщаваме, че атомите на елементите на основните подгрупи на периодичната система затопляне на електрони с.- I. r.- Продукти на външното енергийно ниво и в атомите на елементите на страничните подгрупи, електроните попълват вътрешните линии на техните електронни черупки.
Появата на химична връзка между атомите не е чрез припокриване на нематериални орбитални, но чрез припокриване на електронни облаци, образувани от валентни електрони на свързващите атоми: "Визуалното тълкуване на този проблем е, с конвергенция на два А. водород , техните електронни "облаци" започват да се припокриват все повече. Такова "проникване на" облаци "се придават да знаят вече на разстояние от порядъка на два ангстрема, когато новият ефект става забележим. Електроните на двата атома - ако гърбовете им са противоположни, - "обикновено", което прави съвместно движение в областта на двете ядрени, т.е. Всеки електрон принадлежи на двете ядрени наведнъж. Общият електронен "облак" на двете ядра се деформира, голяма част от този "облак" е между ядрата, общувайки ги заедно "[виж 7, стр. 412].
При разглеждането на посоката на ковалентна химична връзка показват, че атомът може да бъде в три състояния: основният, развълнуван и хибрид. В основното състояние, атомът е при ниска температура и при висока температура - в възбуденото състояние. Когато се образува химическата връзка, атомът се превръща в хибридно състояние. Различните състояния на атомите илюстрират графични електронни формули на външни (валентни) енергийни нива на берилий, бор и въглеродни атоми.
За Берилий атом тези формули имат този вид:
В същото време обясняваме, че при прехода на атом в възбуденото състояние, той абсорбира енергията, която причинява отстраняването на сдвоените електрони и прехода на един от тях към следващия енергиен сублайър. При преместване на атом към хибридно състояние с.- I. r.- Електроните обмен на енергия и тяхната енергия става еднаква. Такова подравняване на енергиите се нарича хибридизация на електронни облаци.
Промяната на енергията определя промяната в конфигурацията на електронните облаци.
sp.- Хибридизираните електронни облаци от два електрона са подредени симетрично под ъгъл от 180 °. В заключение, ние го информираме sp.- Хипебрадизацията на електронните облаци е характерна за всички атоми на елементите на основната подгрупа на втората група от периодичната система D.I. Иметелеев.
Преходът на борвия атом в развълнуваните и хибридни състояния е илюстриращ със следните графични електронни формули:
В същото време обясняваме, че за разлика от берилиевия атом, бореният атом може да бъде в две хибридни състояния: един хибридизира с.- и едно r.-Електронни облаци или хибридизира едно с.- и две. r.-Електронни облаци. sp. Двуелектрическите електронни електронни облаци са разположени под ъгъл от 120 ° един към друг.
Преходът на въглеродния атом в развълнуваните и хибридни състояния чрез илюстриране с помощта на графични електронни формули на трите си държави:
В същото време обясняваме, че за разлика от борвия атом, въглеродният атом може да бъде в три хибридни състояния. В третото хибридно състояние на атома хибридизира едно с.- и три. r.-Електронни облаци и sp. 3-хибридизирани електронни облаци от четири електрона са подредени под ъгъл от 109 ° 28 ".
Описаната техника съответства на принципа на същественост, разпознавайки материалната реалност като основа на всички явления, което позволява да се определи истинската същност и точността на всички теоретични заключения.
Литература
1. Rudzitis g.e.. Химия. Неорганична химия. Урок за обща образователна институция от 8 клас / G. Erudzitis, F.G.Feldman. 9-ти Ед., Перераб. и добавете. М.: Просвещение, 2001.
2. GABRIELYAN O.S.. Химия. 8 клас. Урок за общи образователни институции. 6-то Ед., Стереотип. М.: Drop, 2002.
3. Homchenko g.p. Химия за кандидатите за университети. М.: Висше училище, 1993.
4. По дяволите. Физически количества (терминология, определения, нотация, измерение, единици). Референтно ръководство. М.: Висше училище, 1990.
5. Шукарев с.А. Неорганична химия. Т. I. Урок за химически факултети на университетите. М.: Висше училище, 1970.
6. Дмитриев I.S., Семенов с.Г. Квантовата химия е миналото и настоящето. Разработване на електронни идеи за естеството на химическата връзка. М.: Atomizdat, 1980.
7. Голяма съветска енциклопедия. 2-ри. М.: BSE, 1950, vol. 3.
Или молекула в зависимост от електронната енергия.
Фигурата показва радиалното разпределение на вероятността за намиране на електрон в водородния атом в основното състояние.
Кривата на радиална разпределение на вероятността за намиране на електрон в водороден атом показва, че вероятността за откриване на електрон е максимален в тънък сферичен слой с център в точката на протонното местоположение и радиус, равен на радиуса на Боров А 0.
Колкото по-силно е връзката на електрона с ядрото, електронният облак е по-малък по размер и по-плътна чрез разпределението на таксата.
Електронният облак най-често се изобразява под формата на гранична повърхност (обхващаща приблизително 90% плътност). В този случай обозначението за плътност с помощта на точките се намалява.
Енциклопедичен YouTube.
1 / 3
Какво е орбитал.
# 8 Химия: структурата на атома
Електронна структура атом
Субтитри
Електронен облак и химически
Вярването на движението на електрони, независимо от много по-бавни ядрени движения (адиабатично приближение), може да бъде съвсем строго описано от образуването на химическа връзка в резултат на действието на силите на кулобовете на привличането на положително начислени атомни ядра на електронния облак, концентриран в вътрешното пространство (виж cris.2).
Зареждането на тези облаци има тенденция да донесе ядрото един на друг (свързващ района), докато електронната такса извън интерстициалното пространство (некондизорния регион) има тенденция да избутва ядрото. В същата посока има и силите на ядреното отблъскване. Под сближаването на атомите на равновесното разстояние част от електронната плътност на неопределената зона преминава в обвързване. Електронният заряд се разпространява и в двете области, така че силите да се стремят да донесат и бутнят ядрата са еднакви. Това се постига при определено равновесно разстояние, съответстващо на
Не само електронната енергия в атома (и размера на електронния размер на облака) може да отнеме само определени стойности. Произволен не може да бъде форма на електронен облак. Той се определя от орбитал квантово число I (също се нарича страна или азимутал), който може да приема целочислените стойности от 0 до (P - 1), където P е основният квантово число. Различни стойности на P отговарят на различен брой възможни стойности. Така че, когато n \u003d 1 е възможно само една стойност на орбиталния квантов номер - нула (/ \u003d 0), с n \u003d 2 / може да бъде 0 или 1, когато р \u003d 3 са възможни стойности /, равен на 0, 1 и 2 като цяло тази стойност на основното квантово число n съответства на разнообразието от възможни стойности на орбиталния квантов число.
Заключението, че формите на атомни електронни облаци не могат да бъдат произволни, следва от физическото значение на квантовия номер /. То е определя стойността орбитален момент на броя на електронното движение, Тази стойност, както и енергията, е количествена физическа характеристика на електронната държава в атома.
Орбиталната молитва на количеството m с формула m, движеща се около центъра на въртене в някаква орбита, се нарича продукт mVF, Където t. - маса от частици, в. - скоростта му, г- Радиус вектор, свързващ въртещия център с частица (фиг. 7). Важно е да сваляме, че m е векторно количество; Посоката на този вектор е перпендикулярна на равнината, в която се намират векторите. в. и г.
Някои форма на електронен облак съответства на напълно определена стойност на орбиталния инерция на електронното движение M. но тъй като m може да приема отделни стойности, определени от орбиталния квантов номер /, тогава формата на електронни облаци не може да бъде произволна : Всяка възможна стойност / съответства на напълно определена форма на електронен облак.
Вече знаем, че енергийната енергия в атома зависи от главния квантов брой пс. Във водородния атом, електронната енергия е напълно
Фиг.

Фиг.8. Концепцията за размерите и формата на електронния облак се определя от стойността пс. Въпреки това, в мултилектронни атоми, електронната енергия зависи от стойността на орбиталния квантов номер /; Причините за тази зависимост ще бъдат разгледани в § 31. Ето защо, състоянието на електрона, характеризиращ се с различни ценности /, е обичайно извикано енергийна подслаждам Електрон в атома. Тези подслаждани са присвоили следната бележка:
В съответствие с тези обозначения те казват vol .s-supro, / ^ - лъжливост и др. Електроните, характеризиращи се със стойностите на странично квантово число 0, 1, 2 и 3 се наричат \u200b\u200bсъответно. Електроните, P-електроните, B / -electron и /electron. С тази стойност на главния квантов номер пс тогава най-ниската енергия r-, d- и / -ELECTRONS.
Състоянието на електрона в атома, съответстващ на определени стойности pi i, Той е написан по следния начин: първо, номерът на основния квантов номер е посочен и след това писмото - орбиталното квантово число. Така, обозначението 2 r. се отнася до електрон p \u003d 2i1 \u003d 1, обозначение 3D - на електрон n \u003d. 3 и / \u003d 2.
Електронният облак не е рязко очертан в границите на пространството. Следователно концепцията за нейните размера и форма изисква изясняване. Помислете като примерен облак на електрон 15-електрон в водородния атом (фиг. 8). В точка но, Намира се на известно разстояние от ядрото, плътността на електронния облак се определя от площада на вълновата функция, която щеше да прекарва през точката ноповърхност на равна електронна плътност, Свързващи точки, при които плътността на електронния облак се характеризира със същата стойност J ^. В случай на 15-електрон, такава повърхност ще бъде сфера, вътре в която е част от електронния облак, затворен (на фиг. 8, напречното сечение на тази сфера с модел с равнина се показва, че кръгът преминава през точката но). Изберете точката сега Б, Голяма част от ядрото и също така извършват повърхността на равна електронна плътност през нея. Тази повърхност също ще има сферична форма, но повечето от електронния облак ще бъдат затворени вътре в нея, отколкото вътре в сферата но. Нека най-накрая да бъде вътре в повърхността на електронна плътност, изразходвана чрез някаква точка С, приключва преобладаващата част от електронния облак; Обикновено тази повърхност се извършва, така че да завърши 90% от заряда и масата на електрона. Тази повърхност се нарича гранична повърхност И това е неговата форма и размери, за да се счита за форма и размери на електронния облак. Гранична повърхност

Фиг. девет.Функции FIF 2 графики за 1 S-Electron

Фиг. 10.
15-електронът е сфера, но граничните повърхности ^ - и ^ -Електроните имат по-сложна форма (виж по-долу).
На фиг. 9 показва стойностите на функцията на вълната F (виж фиг. 9, но) и квадрат (виж фиг. 9, 6) За 15-електрон, в зависимост от разстоянието от ядрото, изобразените криви не зависят от посоката, в която се депозира измереното разстояние R; означава, че електронният облак на LS електрона има сферична симетрия. Той има форма на топка. Крива на фиг. девет, но Намира се по един път от ос на разстоянията (Asccissa Axis). От това следва, че функцията на вълната на 15-електрона има постоянен знак; Ще го считаме за положително.
Фигура 9, б. Той също така показва, че с увеличаване на разстоянието от ядрото, стойността на f 2 монотонно намалява. Това означава, че тъй като плътността на 15-електронния електронен облак се намалява от ядрото; Илюстрацията на този изход може да бъде фиг. пет.
Това обаче не означава, че с увеличаване г. Вероятността за откриване на 15-електрона също е едноосновно намалена. На фиг. 10 подчертан тънък слой, сключен между сфери с радиус г. и (g + AR), където AR е някаква малка стойност. С растежа на електронната гъстота на облака в сферичния слой, който се наблюдава; Но в същото време увеличава обема на този слой, равен на 4L G2AR. Както е посочено в § 26, вероятността за откриване на електрон в малко количество AK се изразява от продукта от F 2 DC. В този случай, AK \u003d 4LG 2 AR; Следователно вероятността за откриване на електрон в сферичен слой, сключен между G и (G + AR), е пропорционален на стойността на 4LG 2 F2. В тази работа, с увеличение на Г, мултипликатор 4L G 2, и мултипликатът F 2 намалява. При малки стойности на m, величината на 4L G 2 нараства по-бързо от F 2 намалява с големи - напротив. Следователно, продуктът от 4lg 2 F2, който характеризира вероятността от откриване на електрон на разстояние от ядро, с увеличаване на G преминава през максимум.
Зависимостта на 4LG 2F2 от G е изобразена за 15-електрона на фиг. 11 (Подобни графики се наричат графики на радиал

Фиг. единадесет.

Фиг. 12.Графика на вълната за 25- (но) и 35 електрона б)
вероятност за вероятност След намиране на електрон). Както е показано на фиг. 11, вероятността за откриване на 15-електрона на ниски разстояния от ядрото е близо до нула, тъй като г. малцина. Уволнението и вероятността за откриване на електрон на много дълги разстояния от ядрото: тук е близо до нулев мултипликатор F 2 (виж фиг. 9, 6). На известно разстояние от ядрото g 0. Вероятността за откриване на електрон има максималната стойност. За водородния атом това разстояние е 0.053 nm, което съвпада с изчислената бордова стойност на радиуса, най-близо до ядрото на електронната орбита. Въпреки това, интерпретацията на тази величина в теорията на бор и от гледна точка на квантовата механика е различна: според Бор, електронът в водородния атом разположен На разстояние 0.053 nm от ядрото и от гледна точка на квантовата механика това разстояние съответства само на максимална вероятност Откриване на електрон.
Електронните облаци от 5 електрона от втория, третия и последващите слоеве са притежавани, както в случая на 15 електрона, сферична симетрия, т.е. Характеризиращ се с сферична форма. Въпреки това, тук функцията на вълната с увеличаване на разстоянието от ядрото се променя по-трудно. Както е показано на фиг. 12, зависимост от f от г. За 25- и 35 електрона не са монотосни, на различни разстояния от ядрото, вълната функция има различен знак и има на съответните криви нови точки (или възли) В която стойността на вълната функция е нула. В случай на 25-електрон, има един възел, в случай на 35-електрон - 2 възли и др. В съответствие с това структурата на електронния облак тук също е по-трудна от 15-то електрона. На фиг. 13 Като пример, електронен електронен облак е схематично изобразен.
Графиките на радиалното разпределение на вероятността за 25- и 35 електрона (фиг. 14) имат повече сложни видове. Тук изглежда не един максимум, както в случая с 15-електрон, и съответно, две или три максимални. В същото време основният максимум е по-далеч от ядрото, толкова по-голяма е стойността на главния квантов число пс.

Фиг. 13.

Фиг. четиринадесет.Графики за разпределение на радиални вероятности за 2s- (но) и 35 електрона ( 6 )
Обмислете сега структурата на електронния облак 2 /? - електрон. Когато изваждате от ядрото в някаква посока, функцията на вълната на 2R електрона варира в съответствие с кривата, показана на фиг. петнадесет, но. От едната страна на ядрото (на фигурата - дясно), функцията на вълната е положителна, а тук на кривата има максимум, от другата страна на ядрото (на фигурата - ляво), функцията на вълната е отрицателна има минимум върху кривата; В началото на координатите стойността на F се отнася до нула. За разлика от 5 електрона, вълната функция на 2R електрона няма сферична симетрия. Това се изразява във факта, че височината на максималната (и съответно, дълбочината на минималната) на фиг. 15 зависи от избраната посока на радиуса-вектора г. В някаква посока (за сигурност ще го считаме за посоката на ос на координатите х) Височината на максималната е най-висока (виж фиг. 15, относно).В посоките, които съставляват ъгъла с оста х, Височината на максималната е толкова по-малка, толкова повече този ъгъл (виж фиг. 15, б, в); Ако е 90 °, тогава стойността на F в съответната посока е нула на всяко разстояние от ядрото.
Графиката на радиалното разпределение на вероятността за 2R електрона (фиг. 16) има формата, подобна на фиг. 15, с разликата, че вероятността за откриване на електрон на известно разстояние от ядрото винаги е положителна. Вероятно положението на кривата на разпределение е вероятно

Фиг. шестнадесет.

Фиг. петнадесет.

Фиг.

Фиг.
sti не зависи от избора на посока. Въпреки това, височината на този максимум зависи от посоката: това е най-голямото, когато радиуса-векторът съвпада с посоката на ос х, и намалява като радиус - векторни отклонения от тази посока.
Това разпределение на вероятността за откриване 2 /? - електрон съответства на формата на електронен облак, наподобяващ двойна круша или гира (фиг. 17). Както може да се види, електронният облак е концентриран близо до оста х, И в самолета yz. Перпендикулярна на тази ос, без електронен облак: вероятността за откриване на тук 2R-Electron е нула. Знаци "+" и "-" на фиг. 17 не се отнасят до вероятността за откриване на електрон (винаги е положителен!), И на вълновата функция F, която в различни части на електронния облак има различен знак.
Фигура 17 приблизително прехвърля формата на електронен облак не само 2R-електрони, но и P-електроните на третия и последващите слоеве. Но графиките на радиалното разпределение на вероятността имат по-сложен характер тук: вместо един максимален, показан в дясната част на фиг. 16, на съответните криви има два Максима (S-Electron), се появяват три максимални (4p-електрон) и т.н. В същото време най-големият максимум се намира по-далеч от ядрото.
Още по-сложна форма има електронни облаци (7 електрони (/ \u003d 2). Всяка от тях е "четиричленна" фигура, а признаците на вълната функция в алтернативния "венчелистчета" (Фиг. 18).
6.1. Характеристики на Microvorld
Законите, за които "живеят" частици microworld.(електрони, нуклеони, атоми, молекули) са много различни от законите макромир (Нашият свят е светът на физическите тела). Много в поведението на тези частици нашият мозък, развиващ се в макромир, просто не може да си представи. Ето защо, с някои характеристики на такива частици, функции, които изглеждат неочаквани и странни, ние ще трябва просто да приемем.
От основните свойства на заредените тела и частици следва, че неподвижните електрони в атома не могат да бъдат. Всъщност, в този случай, те, които са се впуснали в ядрото, просто ще паднат върху него, а атмосферата ще спре да съществува. Следователно електроните в атома се движат. Но вече укрепването беше ясно, че електроните не могат просто да се въртят около ядрото. По това време законите на електродинамиката вече са били известни, в съответствие с които електронът, който се въртят около ядрото, е длъжен да загуби постепенно енергията си, която трябва да води в края на краищата, до падането му върху ядрото. Този изключително сложен проблем не винаги е последователен, но е решен през първата трета от двадесети век в резултат на произведенията на много изключителни физици: Нилла Бора, Алберт Айнщайн, Erwin Schrödinger, Werner Geisenberg, Max Born и много други учени. С основните заключения от тези произведения ще се срещнем.
Проучване на електрони, атоми, молекули, както и техните процеси на взаимодействие, ние ще използваме някои моделиПозволявайки ни да получим повече или по-малко визуално представяне на изследваните обекти. Трябва да се помни, че всеки модел описва реалност с една степен на точност и може да се използва само в областта, за която е създадена.
От микровлечните частици ние се интересуваме предимно от електрона. И въпреки че имотите, изложени от електрон в различни условия, ще научите по време на физиката, ще се запознаем накратко три основни характеристики на поведението на електроните в атома.
Първа функция. Енергия на свободния електрон , както и енергията на тялото, може да се промени непрекъснато но енергия на свързания електрон, по-специално електрон в атома, може да отнеме само доста определени стойности.
 Схематично, това е показано на фиг. 6.1, където лявата ос на енергията на мастната линия показва възможните стойности на енергията на свободния електрон и отдясно на една и съща ос по отделни точки - енергийните стойности на електронната енергия в атома. По този начин, електронът в атома може да бъде изцяло на определени държави.
.
Схематично, това е показано на фиг. 6.1, където лявата ос на енергията на мастната линия показва възможните стойности на енергията на свободния електрон и отдясно на една и съща ос по отделни точки - енергийните стойности на електронната енергия в атома. По този начин, електронът в атома може да бъде изцяло на определени държави.
.
При превключване на електрон от едно състояние в друга енергия, абсорбирана или се откроява от порции - quantam.енергия. Следователно, първата характеристика на електронното поведение често се нарича принцип на квантуване Неговата енергия. Тази функция беше поставена от датския физик Нилс през 1913 г. и по-късно получи блестящо експериментално потвърждение.
Втора функция. Електронът в някои случаи показва свойствата на частица на вещество, а в други - вълнови имоти. Такава двойственост на поведението на електрон и други микрочастици (дуализъм) е едно от общите свойства на материята (и вещества и областите). Нарича се " дуализъм на корпускуларната вълна "или " дуализъм вълнообразна частица ".
Свойствата на дължината на вълната на електрона се проявяват, например, когато потокът на електроните се пропуска през най-тънък кристален филм. Електронният поток се държи така, сякаш вълните преминават през този филм, т.е. дифракция (рязане на вълните на препятствия, които се случват по пътя им, ако неговият размер е сравним с дължината на вълната) и интерференция (увеличаване на хребетите и намаляват вълни, когато Наливане на техния приятел на приятел) (значението на тези явления е ясно от фигура 6.2, което показва схемите за дифракция и интерференция на вълните на повърхността на водата на среща на препятствия с една или две дупки). Тази характеристика на поведението на електрона прогнозира френския физик Луис де Броги през 1924 г., а през 1926 г. американският физик Клинтън Никисън за пръв път наблюдава дифракционна картина в взаимодействието на електронния поток с метали. Понастоящем вълновите свойства на електроните се използват широко в изследването на структурата на различни вещества.

Третата функция. С по-голяма точност, позицията на електрона в пространството се определя с по-малка точност, възможно е да се определи скоростта му. И обратно, отколкото с по-голяма точност, се определя скоростта на електрона (абсолютна стойност и посока), въпреки това, с по-малка точност, е възможно да се определи позицията му в пространството.. Това твърдение и вярно е за други микрочастици, наречени " принцип на несигурност ". Този принцип е формулиран от германския физик Werner Geisenberg през 1927 година. Принципът на несигурността "лишава" летяща електронна траектория. Всъщност, ако в някакъв момент знаем точно позицията на електрона в някакъв момент, ние не знаем нищо по принцип за своята скорост и следващия път, когато можем да открием електрон във всяка друга точка на атома, но с различно вероятност.
Теорията на вероятностите се изследва от математиката и ние ще се възползваме само от няколко опростена дефиниция на тази концепция.
В нашия случай вероятността за откриване на електрон във всяка точка на електронната обвивка на атома показва колко често "това се случва там."
MICROVORLD, MACROMIR, квантуализационен принцип, дуализъм на вълнообразните частици, принцип на несигурност, вероятност.
1. Направете примери за физически явления, на които има непрекъсната промяна на a) потенциална енергия, б) кинетична енергия.
2. Поставете основните характеристики на електронното поведение в атома. Какво е поведението на електрона, различава се от поведението на всяко физическо тяло?
3. Как мислите, че можете да задържите границата между микромирома и макромир?
4. В какви случаи при преминаване на електрон в атом от една държава към друга енергия се разпределя и в какво - се абсорбира?
5. Отворете следните твърдения в три групи: а) надеждно, б) вероятно в) е невъзможно.
- Земята се върти около слънцето.
- Земята се върти около Марс.
- Автобусът ще отговаря на спирането за следващата минута.
- Ще вали утре.
- Утре ще бъде слънчево.
- Първият човек ви посреща утре на улицата, който ще бъде човек.
Опитайте се да оцените вероятността от тези събития.
6.2. Орбитал. Квантово число
Необичайните свойства на електрона, нейната двойна природа, специалният характер на движението не се вписва в рамката на класическата механика. Поведението на електрон и други микрочастици се изучава квантовоили механика на вълната.
В квантовата механика поведението на електрон е описано чрез по-скоро сложно уравнение уравнение на вълнатаили шрьодингер уравнение(Наречен Erwin Schrödinger - Австрийска физика, която предложи това уравнение през 1926 г.). Точното решение на уравнението на Schrödinger е възможно само за система от две частици, например за водороден атом. За по-сложни атоми уравнението се решава приблизително с помощта на компютри. Shrödinger уравнение, можете да намерите възможни електронни държави в атома ( атомник орбитал, АД).
За да се избегнат обемисти приблизителни изчисления, често се използва опростен атом модел, който се нарича " сближаване с едно електронно "". Като част от този модел се приема, че всеки електрон се държи в атом, независимо от останалите електрони на този атом - тогава решението на уравнението на Schrödinger е значително опростено. В химията, в повечето случаи има достатъчно този прост модел, така че най-често се използва.
Чрез изготвянето на уравнението на Schrödinger за някои атом и да го вземе, може да се определи кои държави са възможни за електрон в даден атом (в рамките на модела "сближаване на едно електрон" на тези държави и повикване орбитали).
След това може да се изчисли коя енергия има електрон във всяка от тези държави, както и намират други, много важни характеристики на атома. С някои от тях ще се срещнем и.
Уравнението на Schrödinger може да бъде направено не само за атом, но и за молекула (системи, състоящи се от няколко атомни ядра и електрони). Решаване на такова уравнение, възможно е да се намерят възможни състояния на електрона, а не в отделен атом, но в молекулата (макар че изчисленията в този случай са много сложни, трудни и естествено са приблизителни). Тези държави също се наричат \u200b\u200bорбитални, но за разлика от Atom Orbitals - атомните орбитали, които ги наричат молекулярна орбитали (Mo).
За да намерите възможното състояние на електрона в атома, ние не трябва да компилираме и решаваме уравнението на Schrödinger. Тази работа е направена през второто тримесечие на двадесети век като самият Schrödinger и много от неговите последователи. В съответствие с това уравнение всеки атомен орбитал е уникално характеризиран с набор от три цели числа, които се наричат квантово число. Тези номера получават специални имена и нотация:
основното квантово число– н.,
орбитално квантово число– л.и
магнитно квантово число– м..
Тъй като не всички държави на електрона в атома са възможни, комбинациите от тези цифри може да не са такива, а само тези, които отговарят на следните три правила.
Основното квантово число ( н.) могат да приемат всички цели положителни стойности:
n \u003d 1, 2, 3, ...,
Орбитално квантово число ( л.)
може да приема всички целочислени стойности от нула до н.– 1:
л. = 0, 1, 2, … , (н. – 1).
Магнитно квантово число (м.)
може да предприеме всички цели стойности от л. до +. л.включително нула:
м. = – л., … , –1, 0, +1,… ,+ л.
Като се считат за възможни възможни набори от квантови числа, разберете кои държави могат да бъдат електрон в атома (т.е. кой е възможен).
Нека главният квантов номер н. \u003d 1, тогава орбиталният квантомер л. \u003d 0 и магнитното квантово число м. \u003d 0, и само нула. Така, когато н. \u003d 1 е възможно само един АД.
За н. \u003d 2 Орбитална квантова номера л. Може би вече отнема две стойности: 0 и 1, но не повече. Всяка от тези стойности съответства на възможните им стойности. м.: за л.\u003d 0 Магнитното квантово число също е равно на нула и кога л. \u003d 1 магнитното квантово число може вече да отнеме три стойности: -1, 0 и 1. Така, когато н. \u003d 2 Получаваме следните набори от квантови номера:
| н. = 2 | н. = 2 | н. = 2 | н. = 2 |
| л. = 0 | л. = 1 | л. = 1 | л. = 1 |
| м.= 0 | м.= –1 | м.= 0 | м.= 1 |
и всички, няма други комплекти от квантови числа, когато н. \u003d 2 са невъзможни. Следователно броят на АД н. \u003d 2 еднакво четири.
Според по подобен начин можем да получим други АД. Резултатът е даден в първите четири колони на таблица 13. Тази таблица може да продължи за други стойности на основния квантов число.
Набор от атомни орбитали се определя чрез ограничения, наложени върху стойностите на квантовите числа.
Използвайки квантови числа, можем да "наричаме" получените орбитал, т.е. атрибут всеки от тях символ. Символът AO се състои от цифра и по-малка латинска буква, например: 2 с., 3пс., 4е.. Цифрата съответства на основното квантово число и буквата символизира стойността на орбиталния квантов номер съгласно следното правило: л. \u003d 0 съответства на писмото с., л. \u003d 1 съответства на писмото пс., л. \u003d 2 - буква д., л. \u003d 3 - буква е. И след това по азбучен ред. Например:
1с.-Ао обозначава орбита н. \u003d 1 I. л. = 0;
2пс.-Ао обозначава орбита н. \u003d 2 I. л. = 1;
3д.-Ао обозначава орбита н. \u003d 3 I. л. = 2.
Символите на орбита са дадени в последната колона на таблица 13.
Същите символи се използват за обозначаване на електрони, намиращи се в тези орбита, т.е. в тези държави:
2пс.-Електрон - електрон до 2 пс.-Ао
4е.-Електрон - електрон до 4 е.-Ао и т.н.
Поведението на електрон в орбиталите зависи от една от нейните необичайни характеристики обратно. Този специален (без аналози в макромир), характерно за микрочастиците, определяйки техните магнитни свойства. За счетоводството му се използва четвъртото квантово число - допир. Той е обозначен с писмото с.. В различни частици, квантовият номер на завъртане е различен, но за електрон може да отнеме две стойности: с. \u003d 1/2 I. с. = –1/2.
По този начин, електронът в атома е напълно и уникално характеризиращ се с четири квантови номера ( н., л., м. и с.), три от които ( н.,
л. и м.) характеризират орбитала на този електрон и четвърти ( с.) - завъртането му
Таблица 13..Комплекти от квантови номера за различни АД
Обозначаване на AO. |
||||
| Един | ||||
0 |
Един Три |
2с. |
||
0 |
Един Три Пет |
3с. |
||
0 |
0 |
Един Три Пет Седем |
4с. |
В бъдеще ще използваме обозначенията на атомни орбитали, дадени в последната колона на таблица 13.
Атомски орбитални, молекулярни орбитални, квантови числа.
1. Предложете символите на атомните орбитали, за които а) н. = 2, л.\u003d 0; б) н.= 3, л. \u003d 0; в) н. = 3, л. =
2. Какви стойности н. и л. съответстват a) 4 с.-Ао, б) 4 r.-Ао, в) 5 д.Ao, a) 6 р-АД?
3. само в атома с.-Subitals, r.-Subitals, д.- избягали?
4. Колко в Atom 2 r.-Subitals, 3. с.-Вюбители, 4. д.-Вюбители, 4. е.- избягали? Докажете, че те са именно толкова много.
5. Колко атом орбита имат символ от 5 пс., 6с.,
4д., 5е.? Какво квантово число са орбиталите със същия символ?
6. В следните комплекти квантови числа н.,
л. и м. Изберете тези, които съответстват на АД. Посочете знаците на тези АД: а) н. = 2, л. = 0, м. \u003d 0; б) н. = 3, л. = 3, м. \u003d 1; в) н. = 2, л. = 1, м. \u003d 2; д) н. = 3, л. = 2, м. \u003d - 1; д) н. = 3, л. = 0, м. \u003d 2; д) н. = 3, л. = 1, м.= 0.
6.3. Енергия на атомните орбитали. Електронни нива и сайт
 След като научих какви орбитали са възможни в атома, сега ще се опитаме да разберем каква е тяхната енергия, защото ролята на енергията във всички процеси, която се случва във Вселената, е много голяма. Това важи и за Micromeru и до космоса.
След като научих какви орбитали са възможни в атома, сега ще се опитаме да разберем каква е тяхната енергия, защото ролята на енергията във всички процеси, която се случва във Вселената, е много голяма. Това важи и за Micromeru и до космоса.
Енергия ao ( Д. AO) могат да бъдат изчислени от уравнението на Schrödinger и се определя експериментално, което отдавна е направено за атоми от почти всички елементи. Но при изучаване на химията тези точни абсолютни стойности рядко се използват. Обикновено е достатъчно да се знае, че енергията, на която орбиталът е по-голяма и какво по-малко, както и силно или слабо различно в енергийните съседни орбитали. Тази информация дава, например, фиг. 6.3, където енергията на орбиталната енергия на Mendelia Atom (един от последните елементи, електронната структура на атома, който се определя експериментално), и двете ангажирани в електрони, а някои свободни се прилагат върху енергийната ос. Стойностите се прилагат към оста, без стриктно спазване, тъй като с увеличаване на основния квантомер, разликата между енергийните стойности на AO намалява много, така че чертежът, направен по скалата, ще бъде малко. Има друга причина, поради която тази скала обикновено се изобразява, без да отговаря на мащаба: като обвинение на ядрото, енергията на същите орбитали е значително намалена, но общият модел на разпределение на енергийните орбили остава непроменен. Изобразен на фиг. 13 Скалата по-точно отразява една от характеристиките на електронното поведение в атома, което вече ни е известно (в сравнение с фиг. 11).
Както виждате, последователността на състоянията е доста сложна. Обикновено, за по-голяма яснота, получената скала е донякъде променена. Моля, обърнете внимание, че енергията AO зависи от н. и от л.Така че с изключение на оста Д. AO е въведена друга ос. Най-често тази ос л.. Върху полученото поле, позицията на енергията на различни орбитали, но не и точки, но малки квадрати, т.нар. квантови клетки ". В същото време, в допълнение към нарастващата яснота, е възможно да се покаже броят на различните орбитални със същата енергия.
До квантовите клетки задължително посочва символите на орбиталите. Резултатът е така нареченото енергийна диаграма атом.
Енергийната диаграма може да отразява електронната структура на реалния атом, а след това позициите на електроните (както е направено подробно в точка 6.5). Но е възможно да се направи енергийна таблица, за да се покаже последователността на енергията, която все още не е заета от електрони на орбиталите - за произволен мулти-електронен атом, такава диаграма е показана на фиг. 6.4.

В случай на водороден атом, който има само един електрон, картината е много опростена. Както може да се види от енергийната диаграма (фиг. 6.5), в водородния атом, енергията на орбита зависи само от основния квантов число н..
От магнитно квантово число м. Енергийните орбитали не зависят от енергийната диаграма на орбитата със същото н. и л.Но с различен магнитен квантов брой м.с една и съща енергия, групирана заедно електронни помойни (EPA) (виж фиг. 6.4).
Броят на орбиталите на всяка ЕПП е равен на броя на възможните стойности. м. (Виж таблица. 13). Така, 2. пс.-, 3пс.-, 4пс.- и други P-Suplevel Orbitals - три, и 3 д.-, 4д.-, 5д.- и други д.- пет са пет. В общия случай броят на орбиталите на всеки апартамент е равен на 2 л. + 1.
Тъй като всички орбитали имат същия символ, същият символ е самият вярващ. Така, 1. с.-Прообс (1. с.-Epu), образуван от един 1 с.-Ао и 4 е.-EPU - семейство 4 е.-Ао.
На енергийната схема е условно обичайно да има орбитали, възходящи за магнитно квантово число, например за 3 д.-Peep.
| 3д. | |||||
| –2 | –1 | 0 | +1 | +2 |
лявата квантова клетка символизира орбитала с м. \u003d -2, следното - с м. \u003d -1 и след това преди м. = 2.

Субектите със същата стойност на основния квантов брой са обединени в електронни нива (ЕС).
Така, 2. с.- и 2. r.-Продуктите образуват второ електронно ниво; 3. с.-, 3пс.- и 3. д.- преместване на трето електронно ниво.
На енергийни диаграми, показани на фиг. 6.4 и 6.5, подложките на едно ниво са свързани с прави линии. В случай на водороден атом, тези линии са хоризонтални и в случай на мулти-електронен атом - наклонени. Полезно е да се знае, че броят на субловите на същото ниво е равен на броя на това ниво (т.е. главният квантов числа н.), и броят на орбиталите на същото ниво е равен н. 2 .
Понякога електронните нива се наричат \u200b\u200b"енергийни нива". Той е остарял, но все още често се използва името е вярно за водородния атом, но абсолютно не отразява естеството на електронните черупки на мулти-електронните атоми (енергията на атомните орбитали на едно електронно ниво, което имат различно). То е при изучаването на електронната структура на водородния атом (най-простият атом!) Това име е възникнало.
По същия начин, електронните фишове понякога се наричат \u200b\u200b"енергийни пилони". Това име е допустимо, тъй като отразява реалността: в подпродукцията на всеки атом на енергия ao наистина
равен. Но за да не се създаде ненужно объркване, не е необходимо да се използва.
Енергия на AO, квантова клетка, енергиен диаграма атомно, електронно ниво, електронно подуст.
1.Енергия на всеки електрон на същия атом, 1 с. или 2. с.Повече ▼? Кой е по-слаб свързан с сърцевината?
2. Какво Orbitaly, 1 с.-Ао водороден атом или 1 с.-Ао атом на хелий, електроните имат по-голяма енергия? Къде са фиксирани с ядрото?
3. Какви орбитали формират четвъртото електронно ниво?
4. Използвайте броя на АД в а) 3 с.-Epu, B) 4 е.-Пипете.
5. Колко форма на електронна подложка
а) Трето електронно ниво, б) пето електронно ниво, в) Седмо електронно ниво?
6.4. Електронни облаци. Формата и размера на електронния облак
Като се разбира с енергията на електроните, ние ще се опитаме да разберем как се движат електроните в атома, като имат различни енергийни ценности и като цяло, са в различни държави (при различни орбити).
Поради особеностите на поведението на електрона, с които се срещнахме в първия параграф, ние, жителите на макромир, е невъзможно да си представим естеството на такова движение. Това се дължи на факта, че в макромир, в съответствие с представянето на съвременната физика, просто няма аналогия за него. Въпреки това, позицията не е безнадеждна - можем да използваме модела на електронното поведение в атома, в който идеята за електронен облак (ЕО).

За да разберем какво е то, ние приемаме, че можем да имаме много пъти "да направим снимка" електрон в атом (например в водороден атом), т.е. точно да фиксира позицията си във всеки момент от времето. Принципът на несигурността не забранява това. Като се налагат един на друг тези "снимки", ние получаваме картината, показана на фигура 6.6 но. Ако поправяме само позицията на електрона на равнината, в която лежи ядрото, изображението ще бъде малко по-различно (виж фиг. 6.6 б.). И двете чертежи ни дават представа за електронния облак: рисуване но - Изглед на този облак отстрани и рисуване б. - Раздел от облака със самолет, минаващ през ядрото. Снимка но отразява появата на облаците и рисуване б. дава представа за неговата вътрешна структура.
На различни места на електронния облак е вероятно да открие електрон може да бъде различен.
Различната плътност на точки в различни части на фигура 6.6 съответства на различната вероятност за намиране на електрон в тези части на електронния облак.
Вероятността за откриване на електрон във всяка част на облака се характеризира с физическа стойност, наречена електронна плътност (R E). Той се дефинира като съотношение на броя на електроните ( Н. д) до обем ( В.), които те са равномерно попълнени (вж. § 5.9):
Колкото по-голяма е електронната плътност, толкова по-висока е вероятността за намиране на електрон в тази част на облака (и основанията са точки на фиг. 6.6).
Електронната плътност намалява рязко с нарастващо разстояние от ядрото, но е теоретично равно на нула само на безкрайно разстояние от него. От това следва, че Yi няма ясни граници. По посока на ядрото електронната плътност намалява още по-рязко и близо до нея е почти равна на нула.
Електронният облак се характеризира с размера, формата и разпределението в нея на електронната плътност.
Всичко, което говорихме за електронния облак, принадлежи на EO на един орбитал, но електронът може да бъде разположен на различен орбитал. Естествено, електронните облаци в тези случаи също ще бъдат различни, т.е. те ще се различават по размер, форма и разпределение на електронната плътност.
Както отбелязахме, електронният облак няма ясни граници, като краищата изглеждат замъглени в пространството. Какво да разберем под размера на такъв обект и как да го опиша?
За да отговорите на тези въпроси, ще трябва да разберем по-подробно как "подредени" някои електронни облаци, т.е. каква е тяхната структура. Структурата на такава необичайна обект, като електронен облак, се характеризира само с разпределението чрез обема на електронната плътност. Първо се запознайте със структурата на най-простите електронни облаци.
|
|
Да започнем с 1. с.- Не. На върха на ориза. 6.7 показва напречното сечение на този облак с равнина, минаваща през ядрото на атома. В долната част на фигурата се поставя графика, показваща как се променя плътността на електронността в този облак. Такъв график може да изгради много малък "наблюдател", който лети през ос х. и непрекъснато измерване на електронната плътност. Точно същият график ще изгради нашия "наблюдател", ако Flew след 1 с.- В някаква друга посока, но непременно през центъра на облака. Следователно, в 1 с.- разпределението на електронната плътност не зависи от посоката, а формата на този облак е сферичен.
Но не винаги е лесно да си представим формата на електронен облак, рисувайки само графиките на разпределението на електронната плътност. Следователно, обикновено формата на електронен облак го характеризира гранична повърхност.
Като гранична повърхност, такава повърхност е избрана, вътре, която общата вероятност открива електрон, е достатъчно голяма (например: 90; 95 или дори 99%). Но комплектите такива повърхности могат да бъдат избрани за всеки облак, затова сред тях изберете една - повърхността, при която във всеки един момент вероятността за електрона е същата. Има и друг начин за избор на гранична повърхност. В този случай, сред повърхностите със същото (на всяка точка) електронна плътност, повърхността е избрана, върху която електронната плътност е изключително незначително (например, 0.01 или 0.001 e /\u003e a 3, т.е. 1.6 ° 10 ° или 1.6? 10 8 cl / m 3). Граничните повърхности, избрани от тези два метода, се различават по външен вид, се различават един от друг.
Изграждаме гранична повърхност 1 с.- Не. На фиг. 6.7 Спомагателни линии, свързани с тази конструкция, са изобразени от пунктирани. В резултат на това ще получим две сфери: външни ( но) и вътрешен ( б.), между които вероятността за откриване на електрон е равна на 90%. Вътрешната сфера е малка, разположена близо до ядрото и когато се образува атом на химични връзки, присъствието му не се появява, така че обикновено се казва, че 1 с.- Ео има форма на топка.
2. пс.-Eo (фиг. 6.8). Състои се от две идентични части, симетрични за центъра на облака. Между тях, в самолета м. (перпендикулярно на чертежа), електронът не може да бъде. Гранична повърхност 2. пс.- Неговото напречно сечение е посочено в чертежа на писмото но) Прилича на две половини на оранжево и е тяло на въртене (Най-простите тела на въртене са цилиндърът, конуса, топка и торус (приблизителният тор е имал бейгъл) с ос х.. Ако нашият "наблюдател" лети през този облак по оста х.след това диаграмата, която ще изгради, няма да бъде много различна от същия график за 1 с.-Ео, само височината на максималната вода ще бъде малко по-малка. Във всяка друга посока (с изключение на тези, които лежат в самолета м.), например, по директно е.Електронната плътност ще бъде още по-малка, но максималната крива ще остане на същите разстояния от ядрото (виж долния график). Това постоянство на Максима е характерно за други електронни облаци, което ни позволява да избираме във всеки облак в сферата " от "с радиус, в края на коя електронна плътност в тази посока е максимална.
Такъв постоянен радиус и характеризира размера на електронния облак. Този радиус се нарича радиус на електронния облаки означават r. Eo. В случая на орбиталите, разглеждани от нас, на това разстояние от ядрото, електронът ще бъде завъртян, ако не е притежавал свойствата на вълната.

2пс.-Полюгирани с три орбитала, следователно в атома може да бъде три 2 р-Eo. И тъй като електроните са взаимно отблъснати, тези облаци са разположени в пространството, така че максималите на тяхната електронна плътност са възможно най-далеч един от друг. Това е възможно само ако оста на облаците ще бъде взаимно перпендикулярно, например, насочено по осите на правоъгълната координатна система. Следователно 2. р-Eo и означаваме: 2 r. X -, 2 r. Y - и 2 пс. Z -eo (фиг. 6.9). Ако всеки от тези облаци е оформен от един или два електрона, тогава общият електронен облак от всички електрони sublayer поради добавянето на електронна плътност ще има сферична форма (като 1S-eo). Същата сферична форма ще има общите електронни облаци от всеки сублайер, освен ако, разбира се, всеки от отделните облаци ще бъде оформен от един или два електрона. 
Формата и структурата на други електронни облаци е по-сложна. Така 2. с.-Eo, като всичко с.- булката със сферичен, двуслоен (фиг. 6.10 но). Вътре във външния слой с основната максимална електронна плътност има друг слой със значително по-малка електронна плътност.
3пс.-Ео се състои от четири части (фиг. 6.10 б.). Две големи площи са сходни по форма на половинки 2 р-EO, но две малки площи с по-малко електронна плътност се намират по-близо до ядрото. В космическата ос 3 пс.-Електронни облаци, както и ос 2 р-Eo, взаимно перпендикулярно.
С увеличаване на основния квантов номер н. Формата на електронни облаци (c е същото л.) Всичко е все по-сложно, но външните региони на такива облаци остават сходни, геометрично сходни.
Дори по-силен се усложнява от формата на облаци с увеличаване на орбиталния квантов число. Разгледа форма 3. д.- Полша. От петте облака от този сублайер четири във форма са напълно еднакви, а петата от тях се различава (фиг. 6.11) (всъщност ситуацията с петия облак е малко по-сложна) всяка от четирите идентични 3 д.- Съдържанието се формира от четири области, наподобяващи заоблени оранжеви филийки. Петият облак се състои от три части, две от които дистанционно приличат на 2 r.- дърво, и трети форми, подобни на причините около първите две. 
Размерите на електронните облаци зависят от обвинението на ядрото: колкото по-силно е зарядът на ядрото, толкова по-силен е електронът и по-малкият размер на електронния облак. Със същия заряд на ядрото, размерът на облака зависи преди всичко от главния квантов брой н.. Визуално тази зависимост е представена на фиг. 6.12 във формата графики за размер на електронните облаци. На тази диаграма, вертикалната ос се отлага (без стриктно спазване на мащаба на радиусите на електронните облаци, а хоризонталната ос е орбитален квантов номер. Позициите на EO Radii на диаграмата са символично маркирани с кръгове.

Радиусите на електронните облаци със същите стойности на основното квантово число са приблизително равни и с различни стойности н - се различават значително. Поради това електронната обвивка на атома се оказва наслоен. (Точни квантови механични изчисления показват, че радиусите на облаците от един слой се различават леко, но тези разлики са незначителни)
Електронният слой се формира от облаците орбитали на едно електронно ниво. Така че първият електронен слой е оформен с един 1 с.-Eo, вторият - един 2 с.-Eo и три 2 r.- Ео, третата - една - една 3 с.-Ho, три 3 r.-Eo и пет 3 д.- Не. Общият брой на електронните облаци във всеки електронен слой е равен н. 2, където н. - основното квантово число, което служи едновременно и номера на електронния слой.
Облаците от същия слой, характеризиращ се само с стойностите на магнитен квантово число, съответстват на орбиталите на един сън. Кога r.-Приране на различни стойности м. Съответства само различна ориентация на електронните облаци. В облаците на една ЕПА с голямо значение л.Например, в 3 д.- Полша, също различна форма.
Електронен облак, гранична повърхност EO, EO форма, радиус на EO, диаграма на езерото, електронен слой.
1. са електронни облаци в природата? И електрони?
2. Опитайте се да намерите аналогои между електронната обвивка и многоетажна жилищна сграда на оригиналната архитектура.
3. След като позицията на граничната повърхност на електронния облак се избира произволно (по-точно - конвенционално)?
4. Точкови промени в плътността на електроните, записани от "наблюдателя", летящ през 1 с.-Eo по директно A и B (фиг. 6.13). 
5. представител на електронната плътност, записана от "наблюдателя", летящ през 2 r.- а) през центъра на атома в посоката, перпендикулярна на оста х. (Фиг.6.8); б) успоредно на оста х.извън сферата на най-високата електронна плътност; в) успоредно на оста х., улавяне на сферата на най-високата електронна плътност.
6. Какви електронни облаци образуват втория електронен слой?
7. Електронните облаци на орбиталите се различават един от друг със следните комплекти квантови числа: а) н. = 2, л. = 0, м. \u003d 0 I. н. = 2, л. = 1, м. \u003d 0; б) н. = 2, л. = 1, м. \u003d 0 I. н. = 2, л. = 1, м. \u003d 1; в) н. = 1, л. = 0, м.\u003d 0 I. н. = 2, л. = 0, м.
= 0?
8. Колко електронни облаци образуват напълно напълнен четвърти електронен слой?
9. какъв електронен облак от същия атом е по-голям в размер А) 2 r.-Eo или 3. r.-Ео, б) 2 r.-Eo или 3. с.-Eo, в) 1 с.-Eo или 2. r.-
10.Kone от електронни облаци Вижте повече: 1 с.- атом на водород, или 1 с.- атом хелий?
11. Как мислите колко пъти радиусът на 1S-eo уран атом е по-малък от радиуса на същия облак на водородния атом?
12. Какво от следните електронни облаци от същия атом са приблизително същите измерения: 1S-EO, 4P-EOB 3D-EO, 4S-YI, 3S-EO?
6.5. Електрони в атом
Във всеки атом броят на Ао е теоретично безкрайно и броят на електроните е разбира се. Как са електроните "Публикувани" в електронната обвивка?
Вземете (разбира се, психически) ядрото на атомния атомния номер Z. и Z. електрони. Ние последователно ще "хвърлим" един електрон по посока на взетия тон. Електроните ще бъдат привлечени от ядрото и ще заемат (пълнене) някои орбитали. Какъв вид? Каква последователност?
За да отговорим на тези въпроси, трябва да се запознаем със законите (принципи, правила) за попълване на АД от електроните, с други думи, с изграждане на електронна обвивка.
Първи закон ( принципа на най-малко енергия): Електроните в атома заемат орбитал с най-малките възможни енергийни стойности. С други думи, общата енергия на всички електрона на атома трябва да бъде минимална. Ако е така, тогава това състояние на атома се нарича основенили неизправдано. Това е стабилно състояние на атом. Всяко друго състояние на атома се нарича възбуден.
Основното състояние на атома - състоянието на атома с най-ниската енергия. |
Използване на енергийната диаграма на Atom и символично изобразяващи електрони под формата на насочени стрелки ( с. \u003d 1/2) или надолу (s \u003d - 1/2), можем да илюстрираме принципа на най-ниската енергия:

Ако желаете, можем да се възползваме от аналогията на макромир: електрони, пълнене на орбиталите, се държат като вода, пълнеща стъклото. Водата винаги запълва чашата отдолу нагоре и никога - напротив.
Ако електроните бяха "насочени" само принципът на най-ниската енергия, тогава всички Z. електроните на нашия атом ще бъдат 1 с.-. Но това не се случва, защото има втори закон ( принцип на Powsli): не може да има дори два електрона в атома с всичките четири идентични квантови числа
(Швейцарският физик Волфганг Паули се формулира, в малко по-различна форма, този принцип през 1925 г.) .
Припомнете си, че атомният орбитал се характеризира с три квантови номера ( н., л., м.) и Spin Quantum Number ( с.следователно) може да отнеме само две стойности, на един AO може да бъде не повече от два електрона
. С други думи, електронният облак може да бъде оформен само от един или два електрона.
Орбитал без електрони безплатен орбитал, орбитал с един електрон - орбитал с несвратен електрон, орбитал с два електрона - напълнен орбитал.

В ежедневието, често срещаме с един случаен аналог на Pauli принцип: принципът на "един билет е един пътник" работи в железопътната кола. Но на железопътния билет се определят и четири "дискретни параметъра": дата, номер на влака, кола и място.

Правилно поставете първите пет електрона в атома, това е достатъчно, за да се използва принципът на най-малко енергия и принципа на Паули. Нека се опитаме да направим това за такъв атом (Boronom Atom).
За визуален образ на електронна структура, или, както се казва, електронна конфигурация Атомът ще използва енергийната диаграма на мултилектронния атом (фиг. 6.4). На тази диаграма вътре в квантовите клетки, с помощта на стрелки, изобразяване на електрони, които са в тези статуи, които символизират квантовите клетки. В резултат на това за борния атом получаваме енергийната диаграма, показана на фиг. 6.14.
На шестия електрон, който например е в въглеродния атом, възниква проблемът: където е на 2 r.-Peep е по-изгодно да се настани на свободно Ao или на несвързано електрическо ао. 
Третият закон е отговорен за този въпрос, който се нарича правило Hund.(Германският физик Фредерич го формулира през 1927 г.). Припомнете си, че електронът е таксувана частица и следователно електроните се отблъскват един от друг; И ако е така, тя е по-изгодна за тях в различни орбитали на един субла, тъй като електронните облаци от тези орбитали не съвпадат в пространството. Няколко опростена власт на Hund звучи така: в подпродукцията електроните се разпространяват в орбитали, така че модулите да са максимум.
Ако шестият електрон може да стигне до същия орбитал като предишното, тогава сумата на завъртането на квантовите номера на тези електрони според принципа на Паули ще бъде задължително да бъде 1/2 + (-1/2) \u003d 0 (електроните трябва да бъдат с различни завъртания). И ако този електрон ще вземе още 2 r.-Ао, тогава сумата на квантовите числа ще бъде равна на 1/2 + 1/2 \u003d 1, т.е. повече, отколкото в първия случай. Модулът за количество ще се окаже по-голям, отколкото в първия случай, а след това, когато завъртият квантовата числа на двата електрона ще бъде отрицателна. Следователно,
електроните заемат орбитал един апартамент първи по един и едва тогава две,
и шестият електрон ще падне на свободното r.-Орбитал (фиг. 6.15).

В живота, ние сме изправени пред дистанционна аналогия на правилото на Хунд: на последното спиране на непознатите пътници, влизащи в тролейбуса, обикновено седнат първо за всяка седалка и едва тогава - две.
Познаването на енергийната структура на електронните обвивки на атомите и законите, за които електроните образуват тези черупки, можем да изображим електронната конфигурация на атом от почти всеки елемент. За да направите това, трябва да знаем само обвинението на ядрото. Можете, разбира се, да изберете обвинението на ядрото произволно, но тогава е малко вероятно да намерим бързо в структурата на електронните черупки някои системи. Логично е да организирате атомите с цел увеличаване на обвиненията на техните ядра, започвайки с + 1д. Такъв номер се нарича естествени близки елементи(ERE). Фактът, че тази серия може да се основава на класификацията на химическите елементи, стана ясно след творбите на младата английска физика на Хенри Козли, малко след това трагично умря в една от битките на Първата световна война. Последователният номер на елемента в този ред е равен на броя на протоните в ядрото на всеки атом на този елемент и е обозначен със същата буква - Z.. Г. I. Менделеев, който не живееше преди откриването на Кослос, имаше елементи, за да увеличи атомните маси ("атомни везни", както казаха), въпреки че смяташе, че един номер се основава на някаква по-дълбока характеристика.
"Изграждане на" електронни черупки на атоми, ние ще изобразяме техните електронни конфигурации. Един от начините за техния образ е да изградим енергийна графика - вече сме разглобени. Втори път - писане електронна формула атом. Ще се запознаем с него в процеса на работа.
Първият елемент в ERE е водород. Единственият електрон на неговия атом на принципа на най-малко енергия отнема 1 с.-Subital и електронната формула на водородния атом се записва, както следва: 1 с. един. Горният индекс с орбитален символ означава броя на електроните. Единственият електронен облак от този атом (1 с.-Eeo) се формира от един (несвързан) електрон.
Вторият елемент е хелий. Вторият електрон в неговия атом също се стреми към минимум енергия и, ако той има обратното обратно, на принципа на Паули може да вземе същия орбитал. Електронна формула на хелий атом 1 с. 2. Също така единственият електронен облак от този атом се образува от два електрона (чифт електрони).
Третият електрон, който се появява в литиевия атом, на принципа на Паули не може да отнеме 1 с.-Орбитал и принудени да заемат по-голяма енергия 2 с.-Орбитал, образувайки около първата секунда, по-голям по размер, електронен облак. Електронна формула на литиев атом 1 с. 2 2с. 1 .
Последният (четвърти) електрон на атома на следващия елемент - берилий - трябва да вземе същото 2 с.-Орбитал, тъй като все още има свободно място. Електронна формула берилий 1 с. 2 2с. 2, а електронната му обвивка се състои от два облака, всяка от които се образува от чифт електрони. Енергийни диаграми на бор и въглеродни атоми вече сме разглобени (фиг. 24 и 25). Електронни формули на атомите на тези елементи - B 1 с. 2 2с. 2 2пс. 1 и c 1 с. 2 2с. 2 2пс. 2 .
2пс.- Продължава да се пълни със следните елементи, до неонова ( Z. \u003d 10) Приобщаване, че този субъл е напълно запълнен. Електронна формула Neon 1 с. 2 2с. 2 2пс. 6, а електронната му обвивка се състои от пет облака: един облак от първия слой (1 с.-Eo) и четири облаци от втория слой (един 2 с.- и три 2 r.-Eeo) и всички облаци се образуват от електронни двойки.
В атомите на следващия елемент - натрий - последният електрон е принуден да вземе 3 с.-Орбитал, а образуването на третия електронен слой започва със своя електронен облак. Натриева електронна формула 1 с. 2 2с. 2 2пс. 6 3с. 1 .
Третият електронен слой (и естествено третото електронно ниво) продължава да се запълва до аргон включително, но не е напълно запълнен, тъй като от следващия атом - калиев атом - запълването на четвъртия слой започва. Това е така, защото енергията остава празна 3 д.- най-много повече от енергия 4 с.-Продукция. 3. д.-Продуктът започва да се запълва само в скандинавия атом (SC 1 с. 2 2с. 2 2пс. 6 3с. 2 3пс. 6 4с. 2 3д. 1) След завършване на попълването 4 с.-Продукция.
Продължавайки да попълвате електроните атомни орбитали, е възможно да се получат електронни конфигурации и атоми от следните елементи. Необходимо е само тясно да се следи последователността на Sublevel (на фиг. 14) и стриктно спазва принципа на най-ниската енергия, принципа на Паули и правилото Hund.
Електронните формули на атомите на всички елементи са дадени в допълнение 4.
Принципа на най-малко енергия, принципа на Паули,Правило Hund, естествена гама от химични елементи.
1. Колко от всички електрони могат да бъдат разположени в а) 4S-ep, б) 4R-ep, в) 3D-ep, г) 5F-EU? 2. Колко електрона могат да бъдат разположени на всеки от първите пет EHS? Направете обща формула за такова преброяване.
3. Какъв квантов номер е общ за всички електрони на външен електронен слой? Опишете неговата стойност.
4. За атоми Na, mg, al, si, p, s, Cl, AR a) изобразяват енергийните класации, б) пълни електронни формули.